| Сайт-специфическая ДНК-метилтрансфераза (аденин-специфическая) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер EC | 2.1.1.72 | ||||||||
| Номер CAS | 69553-52-2 | ||||||||
| Базы данных | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG запись | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
ДНК-аденинметилаза, (метилаза Dam) (также сайт-специфическая ДНК-метилтрансфераза (аденин-специфическая), EC 2.1.1.72, модификация метилазы, система рестрикции-модификации) - это фермент, который добавляет метильную группу к аденин последовательности 5'-GATC-3 'во вновь синтезированной ДНК. Сразу после синтеза ДНК дочерняя цепь остается неметилированной в течение короткого времени. Это орфанная метилтрансфераза, которая не является частью системы рестрикции-модификации и регулирует экспрессию генов. Этот фермент катализирует следующую химическую реакцию
 S-аденозил-L -гомоцистеин + ДНК 6-метиламинопурин
S-аденозил-L -гомоцистеин + ДНК 6-метиламинопуринЭто большая группа ферментов, уникальных для прокариот и бактериофагов.
E. coli ДНК-аденинметилтрансфераза (Dam) широко используется в методике профилирования хроматина, DamID. В котором Dam сливается с представляющим интерес ДНК-связывающим белком и экспрессируется в виде трансгена в модельном генетически управляемом организме для идентификации сайтов связывания белка.
 Dam метилирует аденин сайтов GATC после репликации.
Dam метилирует аденин сайтов GATC после репликации. Когда ДНК-полимераза делает ошибку, приводящую к несовпадению пары оснований или небольшой вставке или удалению во время синтез ДНК, клетка будет восстанавливать ДНК с помощью пути, называемого репарация несоответствия. Однако клетка должна иметь возможность различать цепочку-матрицу и вновь синтезированную цепь. В некоторых бактериях, цепи ДНК метилированы метилазой Dam, и поэтому сразу после репликации ДНК будет гемиметилирована. Фермент репарации, MutS, связывается с ошибками спаривания в ДНК и рекрутирует MutL, который впоследствии активирует эндонуклеазу MutH. MutH связывает гемиметилированные сайты GATC и при активации избирательно расщепляет неметилированную дочернюю цепь, позволяя геликазе и экзонуклеазам вырезать зарождающуюся цепь в области, окружающей несовпадение. Затем цепь повторно синтезируется ДНК-полимеразой III.
Запуск ориджина репликации (oriC) в бактериальных клетках строго контролируется чтобы репликация ДНК происходила только один раз во время каждого деления клетки. Частично это можно объяснить медленным гидролизом АТФ с помощью DnaA, белка, который связывается с повторами в oriC, чтобы инициировать репликацию. Метилаза Dam также играет роль, потому что oriC имеет 11 5'-GATC-3 'последовательностей (в E. coli). Сразу после репликации ДНК oriC гемиметилируется и на некоторое время изолируется. Только после этого oriC высвобождается и должен быть полностью метилирован Dam-метилазой до того, как произойдет связывание DnaA.
Dam также играет роль в стимулировании и репрессии транскрипции РНК. В Э. coli нижестоящие последовательности GATC метилированы, способствуя транскрипции. Например, ассоциированный с пиелонефритом пили (PAP) изменение фазы в уропатогенной E. coli контролируется Dam посредством метилирования два сайта GATC проксимальнее и дистальнее промотора PAP . Учитывая его роль в регуляции белка в E. coli, ген метилазы Dam несущественен, поскольку нокаут этого гена по-прежнему оставляет бактерии жизнеспособными. Сохранение жизнеспособности, несмотря на нокаут гена матери, также наблюдается у Salmonella и Aggregatibacter actinomycetemcomitans. Однако у таких организмов, как Vibrio cholerae и Yersinia pseudotuberculosis, ген dam необходим для жизнеспособности. Нокаут гена dam в Aggregatibacter actinomycetemcomitans приводил к нарушению регуляции уровней белка, лейкотоксина, а также снижал способность микробов вторгаться в эпителиальные клетки полости рта. Кроме того, исследование стоматологического патогена Streptococcus mutans с дефицитом метилазы Dam выявило нарушение регуляции 103 генов, некоторые из которых обладают кариесогенным потенциалом.
Сходство в каталитических доменах C5-цитозинметилтрансфераз и N6- и N4-аденинметилтрансфераз представляют большой интерес для понимания основ функционального сходства и различий. Метилтрансферазы или метилазы классифицируются на три группы (группы α, β и γ) на основе последовательного порядка определенных 9 мотивов и домена распознавания мишени (TRD). Мотив I состоит из трипептида Gly-X-Gly и называется G-петлей и участвует в связывании кофактора S-аденозилметионин. Мотив II является высококонсервативным среди N4- и N6-аденинметилаз и содержит отрицательно заряженную аминокислоту, за которой следует гидрофобная боковая цепь в последних положениях β2-цепи для связывания AdoMet. Мотив III также участвует в связывании Adomet. Мотив IV особенно важен и хорошо известен при характеристике метилазы. Он состоит из дипролильного компонента и является высококонсервативным среди N6-аденинметилтрансфераз в качестве мотива DPPY, однако этот мотив может варьироваться для N4-аденин- и C5-цитозинметилтрансфераз. Было обнаружено, что мотив DPPY важен для связывания AdoMet. Мотивы IV-VIII играют роль в каталитической активности, тогда как мотивы 1-III и X играют роль в связывании кофактора. Для N6-аденинметилаз последовательный порядок этих мотивов таков: N-конец - X - I - II - III - TRD - IV - V - VI - VII - VIII - C-конец, а метилаза Dam из E. coli следует этому структурная последовательность. Кристаллографический эксперимент 2015 года показал, что метилаза Dam E. coli способна связывать не-GATC ДНК с той же последовательностью мотивов, о которой говорилось; авторы утверждают, что полученная структура может служить основанием для репрессии транскрипции, которая не основана на метилировании.
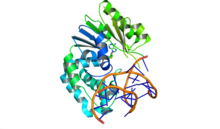 Рентгеновская кристаллическая структура метилазы E. coli Dam показывает фермент, связанный с двухцепочечной ДНК, и ингибитор синефунгин. Модифицируемый аденин показан в виде синей палочки, вывернутой из двойной спирали внутрь фермента.
Рентгеновская кристаллическая структура метилазы E. coli Dam показывает фермент, связанный с двухцепочечной ДНК, и ингибитор синефунгин. Модифицируемый аденин показан в виде синей палочки, вывернутой из двойной спирали внутрь фермента. Дам-метилаза - это орфанная метилтрансфераза, которая не является частью ограничения - система модификации, но действует независимо, регулируя экспрессию генов, репарацию несоответствий и репликацию бактерий среди многих других функций. Это не единственный пример орфанской метилтрансферазы, поскольку существует Метилтрансфераза (CcrM), регулируемая клеточным циклом, которая метилирует полу-метилированную ДНК 5'-GANTC-'3 для контроля жизненного цикла Caulobacter crescentus и другие родственные виды.
В отличие от своих бактериальных аналогов, фаговые орфанные метилтрансферазы также существуют, особенно в T2, T4 и других T-четных бактериофагах, которые инфицируют E. coli. В ходе исследования было выявлено, что, несмотря на общую гомологию последовательностей, аминокислотные последовательности метилазы E. coli и T4 Dam имеют общую идентичность последовательностей до 64% в четырех областях длиной от 11 до 33 остатков, что предполагает общее эволюционное происхождение бактериального и гены фаговой метилазы. Метилазы Т2 и Т4 отличаются от метилазы Dam E. coli не только своей способностью метилировать 5-гидроксиметилцитозин, но также метилировать неканонические участки ДНК. Несмотря на обширную характеристику этих избранных фаговых орфанных метилтрансфераз in vitro, их биологическое назначение до сих пор неясно.