 Внутри- и межцепочечное сшивание ДНК
Внутри- и межцепочечное сшивание ДНК В генетике, сшивание ДНК возникает, когда различные экзогенные или эндогенные агенты реагируют с двумя нуклеотидами из ДНК, образуя между ними ковалентную связь. Эта перекрестная сшивка может происходить внутри одной и той же цепи (внутрицепочечная) или между противоположными цепями двухцепочечной ДНК (межцепочечная). Эти аддукты мешают клеточному метаболизму, например репликации ДНК и транскрипции, вызывая гибель клеток. Однако эти поперечные связи могут быть восстановлены посредством путей удаления или рекомбинации.
Сшивание ДНК также полезно при химиотерапии и воздействии на раковые клетки при апоптозе, а также в понимании того, как белки взаимодействуют с ДНК.
Многие охарактеризованные сшивающие агенты имеют два независимо реакционноспособные группы внутри одной и той же молекулы, каждая из которых способна связываться с нуклеотидным остатком ДНК. Эти агенты разделены на основе их источника происхождения и помечены как экзогенные или эндогенные. Экзогенные сшивающие агенты представляют собой химические вещества и соединения, как натуральные, так и синтетические, которые возникают в результате воздействия окружающей среды, такого как фармацевтические препараты, сигаретный дым или автомобильные выхлопные газы. Эндогенные сшивающие агенты представляют собой соединения и метаболиты, которые вводятся клеточными или биохимическими путями внутри клетки или организма.
| Сшивающий агент | Алкилирующий агент | Структура сшивки | Предпочтительная целевая последовательность |
| Азотный иприт |  |  | Внутри нити; 5'-GC |
| цисплатин |  | 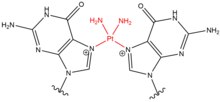 | Intrastrand; 5'-GC Интерстранд; 5'-GNG |
| Кармустин (BNCU) |  | 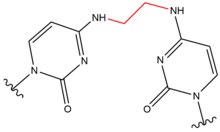 | Межстенд; GC basepair |
| Митомицин C |  |  | Межцепочечный; 5'-GC |
| Псорален |  |  | Интерстенд; 5'-TA |
| малоновый диальдегид |  |  | межцепочечный; 5'-GC, 5'-CG |
| Окислительный стресс (и радиация) |  | Внутрипрядь; d (GpT) | |
| азотистая кислота |  | межпородный; 5'-CG |
Сшитая ДНК репарируется в клетках комбинацией ферментов и других факторов пути эксцизионной репарации нуклеотидов (NER), гомологичная рекомбинация и путь эксцизионной репарации оснований (BER). Для восстановления межцепочечных сшивок у эукариот 3 'эндонуклеаза лоскута из NER, XPF-ERCC1, задействуется в сшитой ДНК, где она помогает «расцепить» ДНК, расщепляя 3'-цепь в сайт перекрестных ссылок. Затем 5'-цепь расщепляется либо XPF-ERCC1, либо другой эндонуклеазой, образуя двухцепочечный разрыв (DSB), который затем может быть восстановлен. посредством пути гомологичной рекомбинации.
Сшивки ДНК обычно вызывают потерю информации о перекрывающихся последовательностях двух цепей ДНК. Следовательно, точное восстановление повреждений зависит от восстановления потерянной информации из неповрежденной гомологичной хромосомы в той же клетке. Извлечение может происходить путем спаривания с сестринской хромосомой, полученной во время предыдущего цикла репликации. В диплоидной клетке извлечение может также происходить путем спаривания с несестринской гомологичной хромосомой, как это происходит особенно во время мейоза. После того, как спаривание произошло, перекрестная связь может быть удалена и исправленная информация введена в поврежденную хромосому путем гомологичной рекомбинации.
Расщепление связи между сахаром дезоксирибозы в сахарофосфатном скелете ДНК и связанным с ним азотистым основанием оставляет основной сайт в двухцепочечной ДНК. Эти базовые участки часто образуются как промежуточные, а затем восстанавливаются при эксцизионной репарации основания. Однако, если этим сайтам позволить сохраняться, они могут ингибировать репликацию и транскрипцию ДНК. Абазовые сайты могут реагировать с аминогруппами на белках с образованием перекрестных связей ДНК-белок или с экзоциклическими аминами других азотистых оснований с образованием межцепочечных перекрестных связей. Чтобы предотвратить межцепочечные или ДНК-белковые сшивки, ферменты пути BER прочно связывают абазический сайт и изолируют его от близлежащих реактивных групп, как показано на примере человеческой алкиладенин-ДНК-гликозилазы (AAG) и 3-метиладенин-ДНК-гликозилазы II (AlkA) E. coli.. Доказательства in vitro продемонстрировали, что межстандартные перекрестные связи, индуцированные абазическим сайтом (DOB-ICL), являются поражением, блокирующим репликацию и сильно ошибочно кодирующим. По сравнению с несколькими другими исследованными TLS pols, pol η, вероятно, вносит вклад в TLS-опосредованную репарацию DOB-ICL in vivo. Используя O-2'-дезоксигуанозин-бутилен-O-2'-дезоксигуанозин (O6-dG-C4-O6-dG) повреждения ДНК, которые представляют собой химически стабильную структуру, была исследована обходная активность нескольких ДНК-полимераз и получены результаты продемонстрировали, что pol η демонстрирует самую высокую активность шунтирования; однако 70% продуктов обхода были мутагенными, содержащими замены или делеции. Увеличение размера незакрепленных промежуточных продуктов репарации увеличивает частоту делеционных мутаций.
Обработка E. coli светом псорален плюс УФ (PUVA ) приводит к образованию межцепочечных сшивок в ДНК клеток. Cole et al. и Sinden и Cole представили доказательства того, что процесс гомологичной рекомбинационной репарации, требующий продуктов генов uvrA, uvrB и recA, может удалить эти поперечные связи в E. coli. Этот процесс кажется достаточно эффективным. Даже несмотря на то, что одной или двух нерепарированных поперечных связей достаточно для инактивации клетки, бактериальная клетка дикого типа может восстанавливать и, следовательно, восстанавливать от 53 до 71 поперечных связей псоралена. Эукариотические дрожжевые клетки также инактивируются одной остающейся перекрестной связью, но дрожжевые клетки дикого типа могут восстанавливать от 120 до 200 перекрестных связей.
Сшивка ДНК-белок может быть вызвана множеством химических и физических агентов, включая переходные металлы, ионизирующее излучение и эндогенные альдегиды, в дополнение к химиотерапевтическим агентам. Подобно перекрестному связыванию ДНК, перекрестные связи ДНК-белок представляют собой повреждения в клетках, которые часто повреждаются УФ-излучением. Эффект ультрафиолета может привести к реактивным взаимодействиям и вызвать сшивание ДНК и белков, которые с ней контактируют. Эти поперечные сшивки представляют собой очень объемные и сложные поражения. В первую очередь они возникают в областях хромосом, которые подвергаются репликации ДНК и мешают клеточным процессам.
Прогресс в методах идентификации структуры прогрессирует, и добавление возможности измерения взаимодействий между ДНК и белком является требованием для полного понимания биохимических процессов. Структура комплексов ДНК-белок может быть картирована посредством фотоиндуцированного образования ковалентной связи между двумя макромолекулами или между двумя различными частями одной макромолекулы. Методология включает ковалентное связывание ДНК-связывающего участка ДНК-связывающего белка, специфичного для целевой последовательности, с фотоактивируемым сшивающим агентом, способным реагировать с нуклеотидами ДНК при воздействии УФ. Этот метод предоставляет информацию о взаимодействии между ДНК и белком в сшивке.
Пути репарации ДНК могут привести к образованию опухолевых клеток. Лечение рака было разработано с использованием сшивающих агентов ДНК для взаимодействия с азотистыми основаниями ДНК для блокирования репликации ДНК. Эти перекрестно-сшивающие агенты обладают способностью действовать в качестве терапии с одним агентом, нацеливая и разрушая определенные нуклеотиды в раковых клетках. Этот результат останавливает цикл и рост раковых клеток; поскольку он подавляет специфические пути репарации ДНК, этот подход имеет потенциальное преимущество в виде меньшего количества побочных эффектов.
У людей основной причиной смерти от рака во всем мире является рак легких, включая немелкоклеточную карциному легких 102>(НМРЛ), на долю которого приходится 85% всех случаев рака легких в Соединенных Штатах. Людей с НМРЛ часто лечат терапевтическими соединениями платины (например, цисплатином, карбоплатином или оксалиплатином) (см. Химиотерапия рака легких ), которые вызывают межцепочечные сшивки ДНК. Среди лиц с NSLC низкая экспрессия гена рака груди 1 (BRCA1 ) в первичной опухоли коррелировала с улучшением выживаемости после химиотерапии, содержащей платину. Эта корреляция подразумевает, что низкий уровень BRCA1 в раке и, как следствие, низкий уровень репарации ДНК, вызывают уязвимость рака для лечения с помощью сшивающих агентов ДНК. Высокий уровень BRCA1 может защищать раковые клетки, действуя в рамках гомологичного рекомбинационного пути репарации, который устраняет повреждения ДНК, вызванные препаратами платины. Уровень экспрессии BRCA1 потенциально является важным инструментом для настройки химиотерапии при лечении рака легкого.
Клинические химиотерапевтические препараты могут индуцировать ферментативные и неферментативные перекрестные связи ДНК-белок. Примером такой индукции являются производные платины, такие как цисплатин и оксалиплатин. Они создают неферментативные перекрестные связи ДНК-белок за счет неспецифического перекрестного сшивания белков, взаимодействующих с хроматином, с ДНК. Сшивание также возможно в других терапевтических средствах либо путем стабилизации промежуточных продуктов ковалентной ДНК-белковой реакции, либо путем создания псевдосубстрата, который улавливает фермент на ДНК. Производные камптотецина, такие как иринотекан и топотекан, нацелены и улавливают специфическую ДНК топоизомеразу 1 (TOP1) путем интеркаляции в интерфейсе фермент-ДНК. Поскольку токсичность этих препаратов зависит от захвата TOP1, клеточная чувствительность к этим соединениям напрямую зависит от уровней экспрессии TOP1. В результате функция этих препаратов заключается в том, чтобы служить в качестве ферментных ядов, а не ингибиторов. Это может быть применено для лечения опухолевых клеток с помощью ферментных ядов TOP 2.