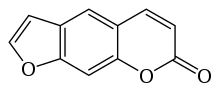
 | |
| Имена | |
|---|---|
| Имя ИЮПАК 7H-furo [3,2-g] chromen- 7-он | |
| Другие названия 7H-фуро [3,2-г] [1] бензопиран-7-он | |
| Идентификаторы | |
| Номер CAS | |
| 3D модель (JSmol ) | |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| ECHA InfoCard | 100.000.581 |
| UNII | |
| Панель управления CompTox (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | C11H6O3 |
| Молярная масса | 186,16 г / моль |
| Точка плавления | от 158 до 161 ° C (от 316 до 322 ° F; От 431 до 434 K) |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Псорален (также называемый псорален ) является исходным соединением в семействе известных органических соединений природного происхождения как линейные фуранокумарины. Он структурно связан с кумарином за счет добавления конденсированного фуранового кольца и может рассматриваться как производное умбеллиферона. Псорален в природе встречается в семенах Psoralea corylifolia, а также в инжир, сельдерей, петрушка, West Индийский атлас, и во всех цитрусовых. Он широко используется в лечении PUVA (псорален + UVA ) для лечения псориаза, экземы, витилиго и кожная Т-клеточная лимфома ; эти приложения обычно связаны с использованием таких лекарств, как Methoxsalen. Многие фуранокумарины чрезвычайно токсичны для рыб, и некоторые из них попадают в водотоки в Индонезии для ловли рыбы.
Псорален - это мутаген, который используется для этой цели в исследованиях молекулярной биологии. Псорален интеркалирует в ДНК, и под воздействием ультрафиолетового (UVA) излучения может образовывать моноаддукты и ковалентные межцепочечные сшивки (ICL) с тиминами, предпочтительно на 5 ' -TpA сайты в геноме, вызывающие апоптоз. Псорален плюс УФА (PUVA) терапия может использоваться для лечения гиперпролиферативных кожных заболеваний, таких как псориаз и некоторых видов рака кожи. К сожалению, лечение PUVA само по себе ведет к более высокому риску рака кожи.
Псорален широко используется в лечении проблем с кожей, таких как псориаз и, в меньшей степени, экзема и витилиго. Это использует преимущество высокого поглощения псоралена УФ. Сначала применяется псорален для сенсибилизации кожи, затем применяется свет УФА для устранения проблем с кожей. Псорален также рекомендован для лечения алопеции. Псоралены также используются в фотоферезе, где они смешиваются с экстрагированными лейкоцитами перед применением УФ-излучения.
Несмотря на фотоканцерогенные свойства псоралена, он использовался в качестве активатора загара в солнцезащитных кремах до 1996 года. Псоралены используются в ускорителях загара, поскольку псорален увеличивает чувствительность кожи. зажечь. У некоторых пациентов наблюдалась серьезная потеря кожи после принятия солнечных ванн с псораленсодержащими активаторами загара. Пациенты со светлой кожей страдают в четыре раза больше от свойств псораленов, вызывающих меланому, чем пациенты с более темной кожей. Краткосрочные побочные эффекты псораленов включают тошноту, рвоту, эритрему, зуд, ксероз, кожную боль из-за фототоксического повреждения кожного нерва и могут вызвать кожные и генитальные злокачественные новообразования.
Оптимизированный псорален может использоваться для инактивации. патогенов в продуктах крови. Синтетический аминопсорален, амотосален HCl, был разработан для инактивации инфекционных патогенов (бактерий, вирусов, простейших) в тромбоцитах и компонентах крови плазмы, подготовленных для переливания крови пациентам. Перед клиническим использованием тромбоциты, обработанные амотосаленом, были протестированы и оказались неканцерогенными при использовании установленной модели мыши с нокаутом p53 . В настоящее время эта технология широко используется в некоторых европейских центрах крови и недавно была одобрена в США.
Псорален интеркалирует в двойную спираль ДНК, где он идеально расположен для образования одного или нескольких аддуктов с соседними пиримидиновыми основаниями, предпочтительно тимином, при возбуждении ультрафиолетовым фотоном.
Несколько физико-химических методов были использованы для получения констант связывания для взаимодействий псорален-ДНК. Обычно две камеры с раствором псоралена и забуференной ДНК разделены полупроницаемой мембраной ; сродство псоралена к ДНК напрямую связано с концентрацией псоралена в камере ДНК после достижения равновесия. Растворимость в воде важна по двум причинам: фармакокинетика, относящаяся к растворимости лекарства в крови и требующая использования органических растворителей (например, ДМСО ). Псоралены также можно активировать при облучении длинноволновым УФ-светом. Хотя свет диапазона UVA является клиническим стандартом, исследования, согласно которым UVB более эффективны при формировании фотоаддуктов, показывают, что его использование может привести к более высокой эффективности и сокращению времени лечения.
Фотохимически реактивные центры в псораленах представляют собой алкеноподобные углерод-углеродные двойные связи в фурановом кольце (пятичленное кольцо) и пироновое кольцо (шестичленное кольцо). При соответствующей интеркаляции рядом с пиримидиновым основанием реакция фотоциклоприсоединения с четырьмя центрами может привести к образованию любого из двух моноаддуктов циклобутильного типа. Обычно моноаддукты фурановой стороны образуются в большей пропорции. Моноаддукт фурана может поглощать второй фотон UVA, приводя ко второму четырехцентровому фотоциклоприсоединению на пироновом конце молекулы и, следовательно, к образованию диаддукта или поперечной сшивки. Моноаддукты пирона не поглощают в диапазоне УФА и, следовательно, не могут образовывать поперечные связи при дальнейшем облучении УФА.
Еще одной важной особенностью этого класса соединений является их способность генерировать синглетный кислород, хотя этот процесс находится в прямой конкуренции с образованием аддукта и может быть альтернативным путем для рассеяния энергии возбужденного состояния.
Исследования псоралена исторически были сосредоточены на взаимодействиях с ДНК и РНК (в частности, на образовании ICL). Однако было показано, что псорален блокирует передачу сигналов рецептора ErbB2, который сверхэкспрессируется при некоторых агрессивных типах рака груди. Синтетическое производное бергаптена, 5- (4-феноксибутокси) псорален, перспективно в качестве иммунодепрессанта, ингибируя специфический калиевый канал. Его структура предотвращает интеркаляцию в ДНК, и он очень слабо производит синглетный кислород, что значительно снижает нежелательную токсичность и мутагенность in vivo. Это имеет значение для лечения различных аутоиммунных заболеваний (например, рассеянного склероза, диабета 1 типа и ревматоидного артрита ). Хотя модификация клеточной поверхности и блокирование ионных каналов - два недавно открытых механизма действия, предстоит еще много исследований.
Большинство фуранокумаринов можно рассматривать как производные псоралена или ангелицина. Псорален и его производные часто называют линейными фуранокумаринами, поскольку они обладают линейной химической структурой. Важные линейные фуранокумарины включают ксантотоксин (также называемый метоксален ), бергаптен, императорин и нодакенетин.

. Структура псоралена была первоначально установлена путем идентификации продукты его реакций разложения. Он демонстрирует нормальные реакции лактона кумарина, такие как раскрытие цикла щелочью с образованием производного кумаровой кислоты. Перманганат калия вызывает окисление фуранового кольца, тогда как другие методы окисления дают фуран-2,3-карбоновую кислоту.
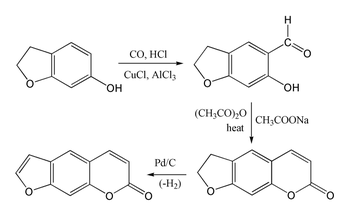
Псорален сложно синтезировать, потому что умбеллиферон подвергается замещению в 8-положении, а не в желаемом 6-м положении. Бензофуран реагирует преимущественно в кольце фуран, а не в кольце бензола. Однако 7-гидроксипроизводное 2,3-дигидробензофурана (также называемое кумараном) действительно подвергается замещению в желаемом положении 6, что позволяет осуществить следующий синтез кумариновой системы посредством реакции Гаттермана-Коха с последующим Конденсация Перкина с использованием уксусного ангидрида. Затем синтез завершают дегидрированием пятичленного кольца с образованием фуранового кольца.
Псорален происходит из кумаринов в пути шикимата ; его биосинтез показан на рисунке ниже. Ароматическое кольцо в 6 активируется в положениях орто по отношению к гидроксильной группе и алкилируется 5, алкилирующим агентом. Затем диметилаллильная группа в 7 подвергается циклизации с фенольной группой с образованием 8. Эта трансформация катализируется цитохром Р-450-зависимой монооксигеназой 17 (псорален-5-монооксигеназа) и кофакторами (НАДФН ) и молекулярным кислородом..
Биосинтетический путь, по которому образуется псорален, показан на рисунке ниже. Второй P-450 -зависимый фермент монооксигеназа (псораленсинтаза ) затем отщепляет 10 (в форме 11) из 8 с образованием 1. Этот путь не включает никаких гидроксилированных промежуточных соединений, и предполагается, что расщепление инициируется радикальной реакцией.

Ficus carica (рис.), вероятно, является наиболее распространенным источником псораленов. В небольших количествах они также встречаются в Ammi visnaga (биснага), Pastinaca sativa (пастернак), Petroselinum crispum (петрушка ), Levisticum officinale (любисток), Foeniculum vulgare (плоды, т.е. семена фенхеля), Daucus carota (морковь), Psoralea corylifolia ( babchi), Apium graveolens (сельдерей), масло бергамота (бергаптен, бергамоттин ).
лечение PUVA продуцирует как межцепочечные сшивки ДНК (ICL), так и моноаддукты. ICL, введенные псораленом, очень генотоксичны для активно реплицирующихся клеток. Ковалентная связь препятствует репликационной вилке Таким образом, перед возобновлением репликации требуется отсоединение ICL. Первоначальные этапы восстановления обычно включают разрезы в одной родительской цепи по обе стороны от поперечной сшивки. Впоследствии восстановление поражения может происходить с помощью точного или неточного процесса.
В соотв. Уратный процесс восстановления поперечных сшивок представляет собой гомологичную рекомбинационную репарацию (HRR). Это включает замену поврежденной информации на неповрежденную информацию из другой гомологичной хромосомы в той же клетке. Клетки Escherichia coli с дефицитом HRR более чувствительны к PUVA по сравнению с клетками дикого типа. HRR кажется эффективным. В E. coli, даже если одной или двух нерепарированных поперечных связей достаточно для инактивации клетки, клетка дикого типа может восстанавливать и, следовательно, восстанавливать от 53 до 71 поперечных связей псоралена. В дрожжах Saccharomyces cerevisiae HRR является основным путем для точного удаления поперечных сшивок псораленом. В дрожжах дикого типа события рекомбинации, связанные с удалением перекрестных связей с помощью HRR, являются преимущественно событиями некроссоверской конверсии гена. Сшивки псораленом в вирусной ДНК, по-видимому, также удаляются в процессе рекомбинационного восстановления, как это происходит в инфицированных вирусом SV40 клетках и в клетках, инфицированных вирусом простого герпеса.
Один неточный процесс восстановления сшивок псораленом, по-видимому, использует ДНК-полимераза, чтобы заполнить промежуток, образовавшийся в цепи с двумя надрезами. Этот процесс неточен, потому что дополнительная неразрезанная цепь все еще сохраняет часть поперечной сшивки и, таким образом, не может служить адекватной матрицей для точного синтеза репарации. Неточный репарационный синтез может вызвать мутацию . Моноаддукты псоралена в цепи матричной ДНК также могут вызывать неточный обход репликации (синтез трансформации ), что может привести к мутации. Было обнаружено, что в фаге Т4 увеличение мутации, наблюдаемое после обработки PUVA, отражает синтез трансфузии ДНК-полимеразой дикого типа, вероятно, из-за несовершенной способности доказательства считывания.
Псоралены могут обратимо сшивать двойные спирали нуклеиновых кислот, и поэтому они широко используются для анализа взаимодействий и структур как ДНК, так и РНК.
| Викискладе есть средства массовой информации, связанные с псораленом. |