 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Азотистая кислота | |
| Систематическое название IUPAC Hydroxidooxidonitrogen | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| 3DMet | |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| ECHA InfoCard | 100.029.057 |
| Номер ЕС |
|
| Справочник Гмелина | 983 |
| KEGG | |
| MeSH | Азот + кислота |
| PubChem CID | |
| UNII | |
| Панель управления CompTox (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | HNO 2 |
| Молярная масса | 47,013 г / моль |
| Внешний вид | Бледно-голубой раствор |
| Плотность | Прибл. 1 г / мл |
| Температура плавления | Известен только в растворе или как газ |
| Кислотность (pK a) | 3,398 |
| Основание конъюгата | Нитриты |
| Опасности | |
| NFPA 704 (огненный алмаз) |  0 4 2 OX 0 4 2 OX |
| Температура вспышки | Невоспламеняющийся |
| Родственные соединения | |
| Другие анионы | Азотные кислота |
| Прочие катионы | Нитрит натрия. Нитрит калия. Нитрит аммония |
| Родственные соединения | Триоксид диазота |
| Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на ink | |
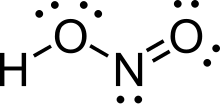
Азотистая кислота (молекулярная формула H N O. 2) представляет собой слабую и монопротоновую кислоту, известную только в растворе, в газовой фазе и в форме нитрита (NO. 2) соли. Азотистая кислота используется для получения солей диазония из аминов. Полученные соли диазония являются реагентами в реакциях азосочетания с образованием азокрасителей.
В газовой фазе планарная молекула азотистой кислоты может принимать оба цис и транс форма. Трансформация преобладает при комнатной температуре, и ИК-измерения показывают, что она более стабильна примерно на 2,3 кДж / моль.

Размеры трансформы. (из микроволновый спектр )

Модель транс-формы

цис-формы
Азотистая кислота обычно образуется подкислением водных растворов нитрита натрия с помощью a минеральная кислота. Подкисление обычно проводят при температуре льда, и HNO 2 расходуется на месте. Свободная азотистая кислота нестабильна и быстро разлагается.
Азотистая кислота кислоту также можно получить растворением триоксида диазота в воде в соответствии с уравнением
Азотистая кислота основной химфор в реактиве Либермана, используемый для выборочного теста на алкалоиды.
Газообразная азотистая кислота, которая встречается редко, разлагается на диоксид азота, оксид азота и вода:
Диоксид азота диспропорционирует до азотной кислоты и азотистой кислоты в водной среде. раствор:
В теплых или концентрированных растворах вся реакция сводится к производству азотной кислоты, воды и оксида азота:
Оксид азота впоследствии может быть повторно окислен воздухом в азотную кислоту, образуя общую реакцию:
ионами I и Fe, NO образуется:
С ионами Sn образуется N 2 O:
С газом SO 2, NH 2 OH образуется:
С Zn в растворе щелочи образуется NH 3 :
С N. 2H. 5, HN 3, и впоследствии образуется газ N 2 :
Окисление азотистой кислотой имеет кинетический контроль над термодинамический контроль, это лучше всего иллюстрирует, что разбавленная азотистая кислота способна окислять I до I 2, но разбавленная азотная кислота не может.
Видно, что значения E. ячейки для этих реакции аналогичны, но азотная кислота является более сильным окислителем. Основываясь на том факте, что разбавленная азотистая кислота может окислять иодид до йода, можно сделать вывод, что закись азота является более быстрым, а не более мощным окислителем, чем разбавленная азотная кислота.
Азотистая кислота используется для получения солей диазония :
где Ar представляет собой арильную группу.
Такие соли широко используются в органическом синтезе, например, для реакции Сандмейера и при получении азокрасителей, ярко окрашенных соединений, которые являются основой качественного теста на анилины. Азотистая кислота используется для разрушения токсичного и потенциально взрывоопасного азида натрия. В большинстве случаев азотистая кислота обычно образуется in situ под действием минеральной кислоты на нитрит натрия : она в основном синего цвета
Реакция с двумя α-атомами водорода в кетонах создает оксимы, которые могут быть дополнительно окислены до карбоновой кислоты или восстановлены с образованием аминов. Этот процесс используется в промышленном производстве адипиновой кислоты.
Азотистая кислота быстро реагирует с алифатическими спиртами с образованием алкилнитритов, которые являются сильнодействующими вазодилататорами :
Канцерогены, называемые нитрозамины, обычно образуются не намеренно, реакцией азотистой кислоты с вторичными аминами :
Азотистая кислота участвует в бюджете озона нижней атмосферы, тропосферы. гетерогенная реакция оксида азота (NO) и воды дает азотистую кислоту. Когда эта реакция происходит на поверхности атмосферных аэрозолей, продукт легко фотолизируется в гидроксил радикалы.
| На Викискладе есть материалы, связанные с азотистой кислотой. |