| Синтез индола Маделунга | |
|---|---|
| Названный в честь | Вальтер Маделунг |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Идентификатор онтологии RSC | RXNO: 0000511 |
Синтез Маделунг является химическая реакция, которая производит (замещенный или незамещенный) индолов с помощью внутримолекулярной циклизации N-фениламиды с использованием сильного основания при высокой температуре. О синтезе Маделунга сообщил в 1912 году Вальтер Маделунг, когда он заметил, что 2-фенилиндол был синтезирован с использованием N-бензоил- отолуидина и двух эквивалентов этоксида натрия в нагретой безвоздушной реакции. Общие условия реакции включают использование алкоксида натрия или калия в качестве основания в гексановых или тетрагидрофурановых растворителях при температурах от 200 до 400 ° C. При синтезе также требуется стадия гидролиза. Синтез Маделунга важен, потому что это одна из немногих известных реакций, которые производят индолы в результате катализируемой основанием термической циклизации N-ацил-о-толуидинов. Общая реакция синтеза Маделунга приводится ниже.

Этот метод по существу ограничен получением 2-алкинилиндолов (которые нелегко получить через электрофильное ароматическое замещение ) из -за жестких условий реакции. Подробный механизм реакции синтеза Маделунга следует ниже.
Реакция начинается с извлечением водорода из азота в амидном заместителе и извлечения бензильного водорода из заместителей орто к амидного заместителю по сильному основанию. Затем карбанион, образующийся в результате экстракции бензильным водородом, осуществляет нуклеофильную атаку на электрофильный карбонильный углерод амидной группы. Когда это происходит, пи-связь амида превращается в неподеленную пару, создавая отрицательно заряженный кислород. После этих начальных этапов сильное основание больше не требуется, и должен происходить гидролиз. Отрицательно заряженный азот протонируется, чтобы восстановить свой нейтральный заряд, а кислород протонируется дважды, чтобы иметь положительный заряд, чтобы стать хорошей уходящей группой. Неподеленная пара от азота образует пи-связь, чтобы удалить положительно заряженную уходящую группу, а также заставляет азот нести положительный заряд. Конечной стадией реакции является реакция элиминирования (в частности, реакция E2 ), которая включает извлечение другого водорода, который когда-то был бензиловым, до образования бициклического соединения, электроны которого преобразуются в новую пи-связь в кольце. система. Это позволяет пи-связи, образованной азотом на предыдущем этапе, превратиться обратно в неподеленную пару на азоте, чтобы восстановить нейтральный заряд азота.
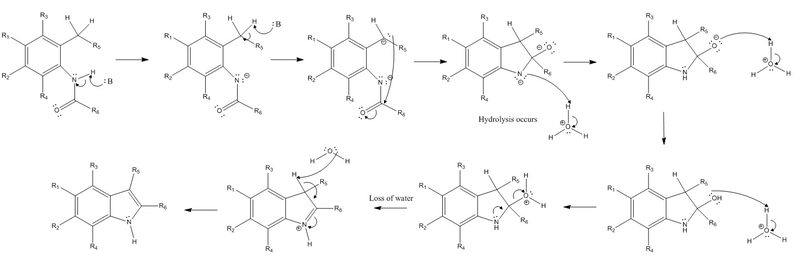
Для увеличения выхода желаемого индольного продукта применялись различные методы. Когда ароматическое кольцо имеет электронодонорные заместители, достигаются более высокие выходы, и наоборот, когда ароматическое кольцо имеет электроноакцепторные заместители. Однако, когда заместитель R5 является электроноакцепторным заместителем, выход увеличивается, а не уменьшается. Кроме того, эффективность реакции также сильно зависит от объема заместителя R6. Чем крупнее эта группа, тем менее эффективна реакция. Условия, необходимые для синтеза Маделунга, довольно жесткие. К счастью, вышеупомянутые модификации были с тех пор применены для повышения его практичности, работая над снижением требуемой температуры, при которой проводится реакция, и увеличением желаемого выхода продукта. Например, когда электронодонорные соединения помещены в ароматическое кольцо N-фениламида и электроноакцепторный заместитель замещен у R5, требуемая температура для реакции снижается примерно до 25 ° C. Еще более впечатляюще то, что исследователи обнаружили, что необходимая температура для синтеза Маделунга снижается до диапазона температур от -20 до 25 ° C, когда используются основания бутиллития (BuLi) и диизопропиламида лития (LDA), а также когда тетрагидрофуран используется в качестве растворитель. Эта конкретная модификация, использование любого из этих опосредованных металлом оснований, называется вариацией Маделунга-Хулихана.
Синтез Маделунга имеет множество важных применений в химии, биохимии и промышленной химии. Эта реакция использовалась при синтезе с выходом 81% архитектурно сложного треморгенного индольного алкалоида (-) - penitrem D, молекулы, естественным образом вырабатываемой грибком спорыньи, который вызывает различные мышечные и неврологические заболевания у домашнего скота. Поскольку этот токсин в конечном итоге вызывает серьезные экономические проблемы в животноводстве, понимание того, как синтезировать и легко разлагать алкалоид (-) - пенитрем D, имеет большое значение. Тем не менее синтез такой сложной молекулы сам по себе был невероятным достижением.
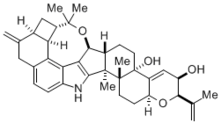 Состав (-) - пенитрем D
Состав (-) - пенитрем D Другой аспект, благодаря которому синтез Маделунга оказался полезным, - это синтез 2,6-дифенил-1,5-диаза-1,5-дигидро- индацена из 2,5-диметил-1,4-фенилендиамина.
Этот синтез был осуществлен без модификации синтеза Маделунга с использованием основания этоксида натрия при температуре 320 - 330 ° C. Показано, что этот индацен представляет собой органический светоизлучающий диод, который может иметь важные применения для недорогих световых дисплеев в коммерческой промышленности.
Модифицированный Смитом синтез Маделунга, также называемый синтезом индола Смита, был открыт в 1986 году Амосом Смитом и его исследовательской группой. Этот синтез использует реакцию конденсации литийорганических реагентов, полученных из 2-алкил-N - триметилсилил анилины с помощью сложных эфиров или карбоновых кислот, дава замещенных индолов. Этот синтез доказал свою применимость к широкому спектру замещенных анилинов, в том числе с алкильными, метокси и галогенидными группами, и может реагировать с неэнолизируемыми сложными эфирами или лактонами с образованием промежуточных соединений N-литиокетамина. Эти промежуточные продукты затем подвергаются внутримолекулярному олефинированию гетероатомом Петерсона с образованием индолининов, которые затем таутомеризуются до 2-замещенных индолов. Синтез индола Смита - одна из наиболее важных модификаций синтеза Маделунга.
Синтез индола Смита начинается с использования двух эквивалентов литийорганического реагента (поскольку литийорганические реагенты являются очень сильными основаниями) для извлечения водорода как из алкильного заместителя, так и из азота, что приводит к отрицательному заряду на обоих. Синтез протекает с нуклеофильной атакой карбаниона на электрофильный карбонильный углерод сложного эфира или карбоновой кислоты. Когда это происходит, пи-связь электрофила превращается в неподеленную пару на кислороде. Эти неподеленные пары затем снова превращаются в пи-связь, что приводит к вытеснению группы -OR. Затем отрицательно заряженный азот выполняет нуклеофильную атаку на соседний электрофильный карбонильный углерод, снова заставляя пи-связь электрофила превращаться в неподеленную пару на кислороде. Этот отрицательно заряженный кислород затем выполняет нуклеофильную атаку на атом кремния триметилсилильной (TMS) группы, в результате чего образуется трициклическое соединение, положительно заряженный атом кремния и нейтральный атом кислорода. Синтез протекает через олефинирование внутримолекулярного гетероатома Петерсона, что в конечном итоге приводит к реакции элиминирования, которая удаляет группу ТМСО и образует пи-связь в пятичленном кольце у атома азота. Затем происходит кето-енольная таутомерия, приводящая к желаемому продукту.
