| Pe олефинирование терсона | |
|---|---|
| Названо в честь | Дональда Джона Петерсона |
| Тип реакции | Реакция связывания |
| Идентификаторы | |
| Портал органической химии | петерсон-олефинирование |
| RSC онтология ID | RXNO: 0000080 |
олефинирование Петерсона (также называемое реакцией Петерсона ) - это химическая реакция α-силилкарбанионов (1 на диаграмме ниже) с кетонами (или альдегидами ) с образованием β-гидроксисилана (2 ), который удаляется с образованием алкенов (3).

Было опубликовано несколько обзоров.
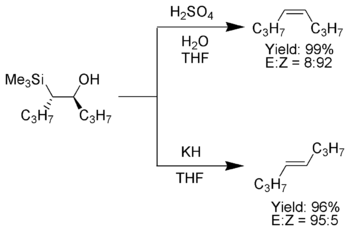
Одной из привлекательных особенностей олефинирования Петерсона является то, что его можно использовать для получения цис- или транс-алкенов из одного и того же β-гидроксисилана.. Обработка β-гидроксисилана кислотой дает один алкен, а обработка того же β-гидроксисилана основанием дает алкен противоположной стереохимии.
Действие основания на β-гидроксисилан (1 ) приводит к согласованному син-элиминированию (2 ) или ( 3 ) с образованием желаемого алкена. Пентакоординат силикат промежуточное соединение (3 ) постулируется, но на сегодняшний день нет доказательств.
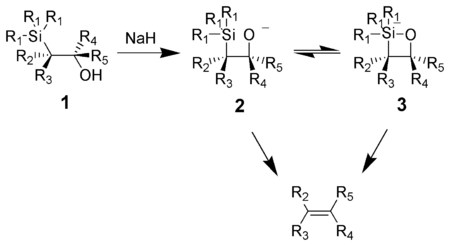
Алкоксиды калия удаляются быстро, в то время как натрия алкоксиды обычно требуют нагревания. Алкоксиды магния удаляются только в экстремальных условиях. Порядок реакционной способности алкоксидов, K>Na>>Mg, соответствует более высокой электронной плотности на кислороде, следовательно, увеличивается нуклеофильность алкоксидов.
Обработка β-гидроксисилана (1 ) кислотой приводит к протонированию и антиэлиминированию с образованием желаемого алкена.

Если α-силилкарбанион содержит только алкил, водород или электронодонорные заместители, стереохимический результат олефинирования Петерсона можно контролировать, поскольку при низкой температуре отщепление происходит медленно и промежуточный β-гидроксисилан может быть выделен.
После выделения разделяют диастереомерные β-гидроксисиланы. Один диастереомер обрабатывают кислотой, а другой - основанием, таким образом превращая материал в алкен с требуемой стереохимией.
Когда α- силилкарбанион содержит электроноакцепторные заместители, олефинирование Петерсона непосредственно образует алкен. Промежуточный β-гидроксисилан нельзя выделить, так как он удаляется на месте. В этих случаях постулируется основной путь элиминации.
Условия кислотного отщепления иногда невозможны, поскольку кислота также способствует двойной связи изомеризации. Кроме того, удаление с помощью натрия или гидрида калия может оказаться невозможным из-за несовместимости функциональных групп. Чан и др. обнаружили, что ацилирование промежуточного силилкарбинола либо ацетилхлоридом, либо тионилхлоридом дает β-силиловый сложный эфир, который самопроизвольно удаляется при 25 ° C, давая желаемый алкен. Кори и соавторы разработали метод (иногда называемый олефинированием Кори-Петерсона) с использованием силилированного имина для получения α, β-ненасыщенного альдегида из карбонильного соединения за одну стадию. Для примера его использования в полном синтезе см.: Общий синтез таксола Кувадзима