A карбанион - это анион, в котором углерод является трехвалентным (образует три связи) и несет формальный отрицательный заряд (по крайней мере, в одной значительной резонансной форме).
Формально карбанион представляет собой сопряженное основание углеродной кислоты :
, где B обозначает основание. Карбанионы, образующиеся в результате депротонирования алканов (у sp-углерода), алкенов (у sp-углерода), аренов (у sp-углерода) и алкинов (у sp-углерода), известны как алкил, алкенил (винил), арил и алкинил (ацетилид) анионы соответственно.
Карбанионы имеют концентрацию электронной плотности у отрицательно заряженного углерода, который в большинстве случаев эффективно реагирует с множеством электрофилов различной силы, включая карбонильные группы, имины / соли иминия, галогенирующие реагенты (например, N-бромсукцинимид и дийодин ) и доноры протонов. Карбанион является одним из нескольких реакционноспособных промежуточных продуктов в органической химии. В органическом синтезе литийорганические реагенты и реактивы Гриньяра обычно обрабатываются и называются «карбанионами». Это удобное приближение, хотя эти частицы обычно представляют собой кластеры или комплексы, содержащие высокополярные, но все же ковалентные связи металл-углеродные связи (M – C), а не настоящие карбанионы.
При отсутствии π-делокализации отрицательный заряд карбаниона локализован на sp-гибридизированной орбитали на углероде в виде неподеленной пары. Как следствие, локализованные алкильные, алкенил / арильные и алкинильные карбанионы имеют тригонально-пирамидальную, изогнутую и линейную геометрию соответственно. Согласно правилу Бента, размещение электронов неподеленной карбанионной пары на орбитали со значительным s-характером является благоприятным, учитывая пирамидальную и изогнутую геометрии алкильных и алкенильных карбанионов соответственно. Теория отталкивания электронных пар валентных оболочек (VSEPR) делает аналогичные предсказания. Это контрастирует с карбокатионами, которые отдают предпочтение незанятым несвязывающим орбиталям с чисто атомарным p-характером, что приводит к плоской и линейной геометриям соответственно для алкильных и алкенильных карбокатионов.
 Алкилкарбанион является тригонально-пирамидным.
Алкилкарбанион является тригонально-пирамидным.  Виниловые анионы являются согнутый. 1,2-Дизамещенные виниловые анионы имеют изомеры E и Z, которые претерпевают инверсию через линейное переходное состояние.
Виниловые анионы являются согнутый. 1,2-Дизамещенные виниловые анионы имеют изомеры E и Z, которые претерпевают инверсию через линейное переходное состояние. Однако делокализованные карбанионы могут отклоняться от этой геометрии. Вместо того, чтобы находиться на гибридной орбитали, неподеленная карбанионная пара может занимать p-орбиталь (или орбиталь с высоким p-характером). P-орбиталь имеет более подходящую форму и ориентацию, чтобы перекрываться с соседней π-системой, что приводит к более эффективной делокализации заряда. Как следствие, алкилкарбанионы с соседними сопряженными группами (например, аллильные анионы, еноляты, нитронаты и т. Д.) Обычно плоские, а не пирамидизированные. Аналогичным образом, делокализованные алкенилкарбанионы иногда предпочитают линейную, а не изогнутую геометрию. Чаще всего для замещенных алкенильных анионов все же предпочтительной является изогнутая геометрия, хотя линейная геометрия лишь немного менее стабильна, что приводит к легкому уравновешиванию между (E) и (Z) изомерами (изогнутого) аниона через линейное переходное состояние. Например, расчеты показывают, что исходный виниловый анион, H 209>2 C = CH, имеет барьер инверсии 27 ккал / моль, в то время как алленильный анион H 2 C = C = CH (↔ H 2 C – C≡CH), отрицательный заряд которого стабилизируется делокализацией, имеет инверсионный барьер всего 4 ккал / моль, что отражает стабилизацию линейного переходного состояния за счет лучшей π-делокализации.
Карбанионы обычно бывают нуклеофильными и основными. Основность и нуклеофильность карбанионов определяются заместителями на углероде. К ним относятся
Геометрия также влияет на орбитальную гибридизацию несущего заряд карбаниона. Чем сильнее s-характер атома, несущего заряд, тем стабильнее анион.
Металлоорганические реагенты, такие как бутиллитий (гексамерный кластер, [BuLi] 6) или метилмагнийбромид (эфирный комплекс, MeMgBr (OEt) 2) часто называют карбанионами, по крайней мере, в ретросинтетическом смысле. Однако на самом деле они представляют собой кластеры или комплексы, содержащие полярную ковалентную связь, хотя с электронной плотностью, сильно поляризованной по направлению к атому углерода. Фактически, настоящие карбанионы без стабилизирующих заместителей недоступны в конденсированной фазе, и эти частицы необходимо изучать в газовой фазе.
В течение некоторого времени не было известно, могут ли простые алкильные анионы существовать в виде свободных частиц; многие теоретические исследования предсказывали, что даже метанид-анион CH 3 должен быть несвязанной разновидностью (т.е. сродство к электрону у CH 3 • было предсказано отрицательным). Такой вид немедленно разложился бы в результате спонтанного выброса электрона и, следовательно, был бы слишком быстрым, чтобы наблюдать его непосредственно с помощью масс-спектрометрии. Однако в 1978 г. метильный анион был однозначно синтезирован путем воздействия на кетен электрического разряда, и сродство к электрону (EA) CH 3 • было определено фотоэлектронной спектроскопией и составило +1,8 ккал-моль, что ограничивало его видов, но едва ли. Структура CH 3 оказалась пирамидальной (C 3v) с ∠ H-C-H = 108 ° и инверсией барьер 1,3 ккал моль, в то время как CH 3 • был определен как плоский (D 3h точечная группа).
Простые первичные, вторичные и третичные sp карбанионы (например,, CH 3CH2, (CH 3)2CH и (CH 3)3C) были впоследствии определены как несвязанные частицы (EA из CH 3CH2•, (CH 3)2CH •, (CH 3)3C • = −6, –7,4, –3,6 ккал моль соответственно), что указывает на то, что α-замещение является дестабилизирующим. Однако относительно умеренные стабилизирующие эффекты могут сделать их связанными. Например, циклопропиловый и кубильный анионы связаны из-за повышенного s-характера неподеленная пара орбиталь, в то время как неопентил и фенэтил-анион также связаны в результате отрицательного гиперконъюгации неподеленной пары с β-заместителем (n C → σ * CC). То же самое верно и для анионов с бензильной и аллильной стабилизацией.Карбанионы в газовой фазе, гибридизованные sp и sp, стабилизируются намного сильнее. ed и часто получают непосредственно путем газофазного депротонирования.
В конденсированной фазе только карбанионы, которые достаточно стабилизированы делокализацией, были выделены как истинно ионные частицы. В 1984 году Olmstead и Power представили литиевую краун-эфир соль карбаниона трифенилметанида из трифенилметана, н-бутиллития и 12-краун-4 (который образует стабильный комплекс с катионами лития) при низких температурах:

Добавление н-бутиллития к трифенилметану (pK a в ДМСО из CHPh 3 = 30,6) в THF при низких температурах, за которым следует 12-краун-4, в результате получают красный раствор и солевой комплекс [ Li (12-краун-4)] [CPh 3 ] осаждается при -20 ° C. Длина центральных связей C – C составляет 145 мкм, при этом фенильное кольцо движется под средним углом 31,2 °. Эта форма пропеллера менее выражена с противоионом тетраметиламмония. Кристаллическая структура аналогичного дифенилметанид-аниона ([Li (12-краун-4)] [CHPh 2 ]), полученная из дифенилметана (pK a в ДМСО из CH 2Ph2= 32,3). Однако попытка выделения комплекса бензил-аниона [CH 2 Ph] из толуола (pK a в ДМСО из CH 3 Ph ≈ 43) была безуспешно из-за быстрой реакции образующегося аниона с растворителем ТГФ. Свободный бензил-анион также был образован в фазе раствора посредством импульсного радиолиза дибензилртути.
В начале 1904 и 1917 годов Шленк получил две соли красного цвета, сформулированы как [NMe 4 ] [CPh 3 ] и [NMe 4 ] [CH 2 Ph], соответственно, путем метатезиса соответствующий натрийорганический реагент с хлоридом тетраметиламмония. Поскольку катионы тетраметиламмония не могут образовывать химическую связь с карбанионным центром, считается, что эти частицы содержат свободные карбанионы. В то время как структура первого была подтверждена рентгеновской кристаллографией почти столетие спустя, нестабильность последнего до сих пор препятствовала структурной проверке. Сообщалось, что реакция предполагаемого "[NMe 4 ] [CH 2 Ph] с водой высвобождает толуол и гидроксид тетраметиламмония, что является косвенным доказательством заявленного состава.
Одним из инструментов для обнаружения карбанионов в растворе является протонный ЯМР. Спектр циклопентадиена в ДМСО показывает четыре винильных протона при 6,5 м.д. и два протона метиленового мостика при 3 м.д., тогда как анион циклопентадиенил имеет единственный резонанс при 5,50 м.д.. Использование Li и Li ЯМР предоставило данные о структуре и реакционной способности для различных литийорганических соединений.
Любое соединение, содержащее водород, в принципе может подвергаться депротонированию с образованием своего конъюгированного основания. Соединение представляет собой углеродную кислоту, если депротонирование приводит к потере протона у атома углерода. По сравнению с соединениями, которые обычно считаются кислотами (например, минеральные кислоты, такие как азотная кислота, или карбоновые кислоты, такие как уксусная кислота), углеродные кислоты обычно на много порядков слабее, хотя существуют исключения (увидеть ниже). Например, бензол не является кислотой в классическом аррениусовском смысле, поскольку его водные растворы нейтральны. Тем не менее, это очень слабая кислота Бренстеда с оценкой pKa 49, которая может подвергаться депротонированию в присутствии супероснования, такого как основание Лохмана – Шлоссера (n-BuLi: KOt -Бу). В качестве конъюгированных кислотно-основных пар факторы, определяющие относительную стабильность карбанионов, также определяют порядок значений pK a соответствующих углеродных кислот. Кроме того, значения pK a позволяют предсказать, будет ли процесс переноса протона термодинамически благоприятным: для того, чтобы депротонирование кислого вещества HA основанием B было термодинамически благоприятным (K>1), соотношение pK a (BH)>pK a (AH) должно выполняться.
Эти значения ниже представляют собой значения pK a, определенные в ДМСО, который имеет более широкий полезный диапазон (от ~ 0 до ~ 35), чем значения, определенные в воде (от ~ 0 до ~ 14), и лучше отражают основность карбанионов в типичных органических растворителях. Значения меньше 0 или больше 35 оцениваются косвенно; следовательно, численная точность этих значений ограничена. Водные значения pK a также часто встречаются в литературе, особенно в контексте биохимии и энзимологии. Более того, водные значения часто приводятся во вводных учебниках по органической химии из педагогических соображений, хотя вопрос о зависимости от растворителей часто замалчивается. Обычно значения pK a в воде и органическом растворителе значительно различаются, когда анион способен образовывать водородные связи. Например, в случае воды значения резко различаются: pK a в воде или воде = 14,0, тогда как pK a в ДМСО воды = 31,4, что отражает различную способность вода и ДМСО для стабилизации гидроксид-аниона. С другой стороны, для циклопентадиена числовые значения сопоставимы: pK a (Cp-H) = 15, тогда как pK a (Cp-H) = 18.
| имя | формула | структурная формула | pKa |
|---|---|---|---|
| Циклогексан | C6H12 | ~ 60 | |
| Метан | CH4 |  | ~ 56 |
| Бензол | C6H6 | ~ 49 | |
| Пропен | C3H6 | ~ 44 | |
| Толуол | C6H5CH3 | ~ 43 | |
| Аммиак (NH) | NH3 |  | ~ 41 |
| Дитиан | C4H8S2 |  | ~ 39 |
| Диметилсульфоксид | (CH 3)2SO |  | 35,1 |
| Дифенилметан | C13H12 |  | 32,3 |
| Ацетонитрил | CH3CN | 31,3 | |
| Анилин (NH) | C6H5NH2 | 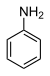 | 30,6 |
| Трифенилметан | C19H16 |  | 30,6 |
| Фтороформ | CHF 3 |  | 30,5 |
| Ксантен | C13H10O |  | 30,0 |
| Этанол (OH) | C2H5OH | 29,8 | |
| Фенилацетилен | C8H6 |  | 28,8 |
| Тиоксантен | C13H10S | 28,6 | |
| Ацетон | C3H6O |  | 26,5 |
| Хлороформ | CHCl 3 |  | 24,4 |
| Бензоксазол | C7H5NO | 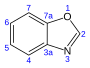 | 24,4 |
| Флуорен | C13H10 | 22,6 | |
| Инден | C9H8 | 20,1 | |
| Циклопентадиен | C5H6 |  | 18,0 |
| Нитрометан | CH3NO2 | 17,2 | |
| Диэтилмалонат | C7H12O4 |  | 16,4 |
| Ацетилацетон | (H3CC (O)) 2CH2 |  | 13,3 |
| Цианистый водород | HCN | 12.9 | |
| Уксусный AC id (OH) | CH3COOH | 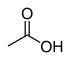 | 12,6 |
| Малононитрил | C3H2N2 |  | 11,1 |
| Димедон | C8H12O2 | 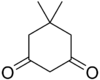 | 10,3 |
| кислота Мелдрума | C6H8O4 |  | 7,3 |
| Гексафторацетилацетон | (F3CC (O)) 2CH2 | 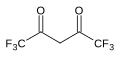 | 2.3 |
| Хлороводород (Cl-H) | HCl | HCl (г) | –2.0 |
| Трифлидная кислота | HC (SO 2CF3)3 | ~ –16 | |
| Таблица 1. Углеродистая кислотность по p Ka в ДМСО. Эти значения могут значительно отличаться от значений pK a в водной среде. | |||
Обратите внимание, что уксусная кислота, аммиак, анилин, этанол и хлористый водород не являются углеродными кислотами, а являются обычными кислотами, показанными для сравнения.
Как указано в приведенных выше примерах, кислотность увеличивается (pK a уменьшается) при делокализации отрицательного заряда. Этот эффект возникает, когда заместители карбаниона являются ненасыщенными и / или электроотрицательными. Хотя углеродные кислоты обычно считаются кислотами, которые намного слабее, чем «классические» кислоты Бренстеда, такие как уксусная кислота или фенол, кумулятивный (аддитивный) эффект нескольких электроноакцепторных заместителей может привести к кислотам, которые являются такими же сильными или более сильными, чем неорганические минералы. кислоты. Например, тринитрометан (HC (NO 2)3), трицианометан (HC (CN) 3), пентацианоциклопентадиен (HC 5 (CN) 5), и фульминовая кислота (HCNO) - все сильные кислоты со значениями pK a в водной среде, которые указывают на полный или почти полный перенос протона в воду. Трифлидовая кислота с тремя сильно электроноакцепторными трифлильными группами имеет расчетное значение pK a значительно ниже –10. На другом конце шкалы считается, что углеводороды, содержащие только алкильные группы, имеют значения pK a в диапазоне от 55 до 65. Диапазон констант кислотной диссоциации для углеродных кислот, таким образом, охватывает более 70 порядков величины.
Кислотность α-водорода в карбонильных соединениях позволяет этим соединениям участвовать в синтетически важных реакциях образования связи C – C, включая альдольную реакцию и добавление Майкла.
С молекулярной геометрией карбаниона, описанного как тригональная пирамида, вопрос в том, действительно ли карбанионы могут отображать хиральность, потому что, если активационный барьер для инверсии этой геометрии слишком низок, любая попытка введения хиральности закончится рацемизацией, подобно инверсии азота. Однако существуют веские доказательства того, что карбанионы действительно могут быть хиральными, например, в исследованиях, проведенных с некоторыми литийорганическими соединениями.
Первое доказательство существования хиральных литийорганических соединений было получено в 1950 году. Реакция хирального 2-иодоктана с втор-бутиллитием в петролейном эфире при -70 ° C с последующей реакцией с сухой лед давал в основном рацемическую 2-метилмасляную кислоту, но также и количество оптически активной 2-метилоктановой кислоты, которая могла образоваться только из аналогичного оптически активного 2-метилгептиллития. с атомом углерода, связанным с карбанионом лития:

При нагревании реакции до 0 ° C оптическая активность теряется. В 1960-х последовали новые доказательства. Реакция цис-изомера 2-метилциклопропилбромида с втор-бутиллитием снова с последующим карбоксилированием сухим льдом давала цис-2-метилциклопропилкарбоновую кислоту. Образование транс-изомера указывало бы на нестабильность промежуточного карбаниона.

Таким же образом реакция (+) - (S) -1-бром-1-метил-2,2-дифенилциклопропана с н- бутиллитий с последующим гашением метанолом приводил к продукту с сохранением конфигурации :

В последнее время появились хиральные соединения метиллития:
![Chiral Oxy [2H1] methyllithiums, Bu обозначает бутил, i-Pr обозначает для изопропил](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1d/PhosphatePhosphonateRearrangement.png/500px-PhosphatePhosphonateRearrangement.png)
фосфат 1содержит хиральную группу с водород и дейтериевый заместитель. Группа станнила заменяется литием на промежуточное соединение 2, которое превращается в фосфоран 3, который при реакции с уксусной кислотой дает спирт 4. И снова в диапазоне от -78 ° C до 0 ° C хиральность сохраняется в этой последовательности реакций.
Карбанионная структура впервые появилась в механизме реакции для конденсация бензоина, как правильно предложили Кларк и Артур Лэпворт в 1907 году. В 1904 Вильгельм Шленк подготовил Ph 3 CNMe. 4в поисках для пятивалентного азота (из хлорида тетраметиламмония и Ph3CNa ), и в 1914 году он продемонстрировал, как триарилметильные радикалы могут быть восстановлены до карбанионов щелочными металлами. Фраза карбанион была введена Уоллисом и Адамсом в 1933 году как отрицательно заряженный аналог иона карбония