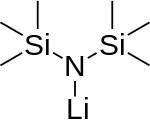
 . Мономер (не существует) . Мономер (не существует) | |
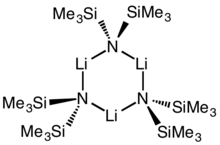 . Циклический тример . Циклический тример | |
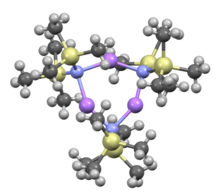 | |
| Названия | |
|---|---|
| Предпочтительное название IUPAC 1,1,1-триметил-N- (триметилсилил) силанаминид лития | |
| Другие названия Гексаметилдисилазид лития. Гексаметилдисилазановая литиевая соль | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) |
|
| ChemSpider | |
| ECHA InfoCard | 100.021.569 |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
SMILES
| |
| Свойства | |
| Химическая формула | C6H18LiNSi 2 |
| Молярная масса | 167,326 г / моль |
| Внешний вид | Белое твердое вещество |
| Плотность | 0,86 г / см при 25 ° C |
| Температура плавления | От 71 до 72 ° C (от 160 до 162 ° F; От 344 до 345 K) |
| Температура кипения | от 80 до 84 ° C (от 176 до 183 ° F; от 353 до 357 K) (0,001 мм рт. Ст.) |
| Растворимость в воде | разлагается |
| Растворимость | Большинство апротонных растворителей. ТГФ, гексан, толуол |
| Кислотность (pK a) | 26 |
| Опасности | |
| Основная опасности | легковоспламеняющиеся, коррозионные |
| Родственные соединения | |
| Родственные соединения | Бис (триметилсилил) амид натрия. Бис (триметилсилил) амид калия |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки ink | |
Литий бис (триметилсилил) амид представляет собой литиированное кремнийорганическое соединение с формулой LiN (SiMe 3)2. Обычно его обозначают сокращенно LiHMDS (liтий h exa m этил disилазид - ссылка на его конъюгат с кислотой HMDS ) и в основном используется как сильное ненуклеофильное основание и в качестве лиганда . Как и многие литиевые реагенты, он имеет тенденцию к агрегации и образует циклический тример в отсутствие координирующих частиц.
LiHMDS имеется в продаже, но его также можно получить депротонированием бис (триметилсилил) амина с помощью н-бутиллития. Эту реакцию можно проводить на месте.
После образования соединение может быть очищено сублимацией или дистилляция.
LiHMDS часто используется в органической химии в качестве сильного ненуклеофильного основания. Его конъюгат кислота имеет pKa ~ 26, что делает ее менее основной, чем другие литиевые основания, такие как LDA (pKa конъюгированной кислоты ~ 36), но она более стерически затрудненный и, следовательно, менее нуклеофильный. Его можно использовать для образования различных литийорганических соединений, включая ацетилиды или еноляты лития.

как таковые, он находит применение в ряде реакций сочетания, в частности, в реакциях образования углерод-углеродной связи, таких как алкилирование Фратера-Зеебаха и смешанная конденсация Клайзена.
Альтернативный синтез тетранитрида тетрасеры влечет за собой использование [(Me 3 Si) 2N]2S в качестве предшественника с pre-fo ср. облигации S – N. [(Me 3 Si) 2N]2S получают реакцией бис (триметилсилил) амида лития и дихлорид серы (SCl 2).
[((CH 3)3Si) 2N]2S реагирует с комбинацией SCl 2 и сульфурилхлорид (SO 2Cl2) с образованием S 4N4, триметилсилилхлорида, и диоксид серы:
LiHMDS может реагировать с широким диапазоном галогенидов металлов посредством реакции метатезиса солей с образованием металла бис (триметилсилил) амиды.
Бис (триметилсилил) амидные комплексы металлов являются липофильными благодаря лиганду и, следовательно, растворимы в ряде неполярных органических растворителей, что часто делает их более реакционноспособными, чем соответствующие галогениды металлов, солюбилизация которых может быть затруднена. стерическая масса лигандов делает их комплексы дискретными и мономерными, что еще больше увеличивает их реакционную способность. В качестве основания эти соединения обычно реагируют с предшественниками протонных лигандов с образованием других комплексов металлов и, следовательно, являются важными предшественниками более сложных координационных соединений.
LiHMDS является летучим и обсуждался для использовать для осаждения атомного слоя соединений лития.
Как и многие литийорганические реагенты, бис (триметилсилил) амид лития может образовывать агрегаты в растворе. Степень агрегации зависит от растворителя. В координирующих растворителях, таких как простые эфиры и амины, преобладают мономер и димер. В мономерном и димерном состоянии одна или две молекулы растворителя связываются с литиевыми центрами. С аммиаком в качестве донорного основания бис (триметилсилил) амид лития образует трисольватированный мономер, который стабилизируется межмолекулярными водородными связями. В некоординирующих растворителях, таких как ароматические соединения или пентан, преобладают комплексные олигомеры, включая тример. В твердом состоянии структура является тримерной.
 | ||||
 . Аддукт LiHMDS с TMEDA . Аддукт LiHMDS с TMEDA |  . THF сольватированным димером: (LiHMDS) 2 • THF 2 . THF сольватированным димером: (LiHMDS) 2 • THF 2 |  . Тример, без растворителя: (LiHMDS) 3 . Тример, без растворителя: (LiHMDS) 3 | ||