 | |
| Идентификаторы | |
|---|---|
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.014.951 |
| Номер EC |
|
| PubChem CID | |
| Панель управления CompTox (EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
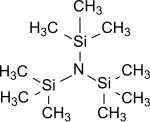
| Химическая формула | C9H27NSi 3 |
| Молярная масса | 233,57 г / моль |
| Внешний вид | Воскообразное твердое вещество |
| Точка плавления | 67–69ºC |
| Точка кипения | 215ºC (85ºC при 13 мм рт. Ст.) |
| Растворимость | Неполярные органические растворители |
| За исключением случаев, когда иное отмечено, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на ink | |
Трис (триметилсилил) амин представляет собой простейший трис (триалкилсилил) амин, который ch имеют общую формулу (R 3 Si) 3 N, в которой все три атома водорода аммиака заменены на триметилсилильные группы (- Si (CH 3)3). Трис (триметилсилил) амин в течение многих лет находился в центре научного интереса как стабильный промежуточный продукт в химической фиксации азота (т.е. преобразовании атмосферного азота N2в органические субстраты при нормальных условиях. Условия ).
Ранние попытки получить трис (триметилсилил) амин из аммиака и триметилхлорсилана (TMS-Cl) не увенчались успехом даже при температуре 500 ° C и в присутствии основания пиридина. Реакция аммиака и триметилхлорсилана останавливается на стадии дважды силилированного продукта бис (диметилсилил) амина (обычно обозначаемого гексаметилдисилазаном, HMDS).

Трис (триметилсилил) амин получают реакцией натриевой соли гексаметилдисилазана - из m гексаметилдисилазан и амид натрия или из гексаметилдисилазана, натрий и стирол - с триметилхлорсиланом с выходом 80% .
Литиевая соль гексаметилдисилазана - из гексаметилдисилазана и фениллитий-гексаметилдисилазана и фениллитий-105122актов только триметилхлорсилан с выходами 50-60% по трис (триметилсилил) амина.
Реакция нитрида лития с триметилхлорсиланом может быть проведена в однореакторном режиме в ТГФ с выходом 72%.

Трис (триметилсилил, бесцветный, бесцветный) амин кристаллическое или воскообразное твердое вещество, устойчивое к воде и основаниям. Спирты или кислоты, хотя и расщепляют Si-N-связь при образовании аммиака.
Из трихлорида сурьмы и трис (триметилсилил) амина кластер нитридоантимонного кубанового типа может быть образован почти количественно при –60 ° C.
Кетоны могут быть трифторметилированы в присутствии P4-t-Bu и нонаметилтрисилазана в мягких условиях. ионы с выходом до 84% с инертным фтороформом (HCF 3, HFC-23).
мономер трихлор (триметилсилил)) -фосфоранимин Cl 3 P = NSiMe 3 образуется из трис (триметилсилил) амина и пентахлорида фосфора в гексане при 0 ° C.,

который может быть полимеризован в линейные полидихлорфосфазены с определенными молекулярными массами и полидисперсностями.
Циклический тример (NPCl 2)3гексахлорциклотрифосфан преимущественно образуется из трис ( триметилсилил) амин и пентахлорид фосфора в кипящем дихлорметане (около 40 ° C) среди других олигомеров, который дает при нагревании выше 250 ° C полидихлорфосфазены с высокой молекулярной массой, мало определяемые.
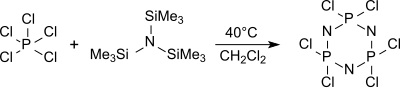
Трифторид азота NF3(который используется, в частности, для плазменного травления кремниевых пластин) получают из трис (триметилсилил) амина и фтора при –40 ° C в ацетонитриле., подавление образования азота и тетрафторгидразина, которые образуются как нежелательные побочные продукты при стандартном синтезе трифторида азота из аммиака или фторида аммония.

Техническая фиксация азота стала возможной благодаря процессу Хабера-Боша, в котором азот превращается в аммиак путем восстановительного протонирования в присутствии железных катализаторов при высоких давлениях (>150 бар ) и температуры (>400 ° C). При химической фиксации азота (т.е. превращении атмосферного азота при нормальных условиях в реактивные исходные материалы для химического синтеза, обычно также аммиак) трис (триметилсилил) амин играет важную роль в так называемом восстановительном силилировании, так как гидролизуется водой до аммиака.
![{\displaystyle {\ce {{N2}+{6e^{-}}->[{\ ce {Catalyst:} } \ {\ ce {Mo}}, \ {\ ce {Fe}}, \ {\ ce {Co}}]}} {\ begin {case} {\ ce {->[{\ ce {H +}} ]}} {\ ce {2NH3}} \\ {} \\ {\ ce {->[{\ ce {R3Si-X}}] [- \, {\ ce {X -}}]}} и {\ ce {2N (SiR3) 3}} \ end {cases}}}]( https://wikimedia.org/api/rest_v1/media/math / render / svg / 7aa5ae0b13d71a31c97f22297303dee5ed50221a )
Еще в 1895 году было обнаружено, что металлический литий реагирует с азотом с образованием нитрида лития при комнатной температуре. В 1972 году К. Шиина наблюдали, что литий (в качестве донора электронов ) образуется с триметилсилилхлоридом при затемнении трис (триметилсилил) амина в присутствии хлорида хрома (III) в качестве катализатор при комнатной температуре с азотом, используемым для инертизации.
![{\displaystyle {\ce {N2 + 6Me3SiCl + 6}}\,{\color {NavyBlue}{\ce {Li}}}\ {\ce {->[{\ ce {CrCl3}}] 2N (SiMe3) 3 + 6}} \, {\ color {NavyBlue} { \ ce {Li}}} {\ ce {Cl}}}]( https://wikimedia.org/api/rest_v1/media/math/render/ svg / b7e5556a07b9c108214c4261b7694524d5af5665 )
Совсем недавно для восстановительного силилирования N 2 натрий использовался вместо лития в качестве донора электронов и молибдена и соединений железа (например, как пентакарбонильное железо или ферроцены ) в качестве катализаторов, на одно железо может быть получено до 34 эквивалентов N (Me 3 Si) 3 атом в катализаторе.
![{\displaystyle {\ce {N2 + 6Me3SiCl + 6}}\,{\color {Red}{\ce {Na}}}\ {\ce {->[{\ ce {Fe-катализатор}}] 2N (SiMe3) 3 + 6}} \, {\ color {Red} {\ ce {Na}} } {\ ce {Cl}}}]( https://wikimedia.org/api/rest_v1/media/math/render/svg/ecf55c39b3edb4a67900c2fb80e508b6a1b31d91 )
При использовании комплекса молибден-ферроцен в качестве катализатора число оборотов до 226.
![{\displaystyle {\color {Red}{\ce {N2}}}+{\color {NavyBlue}{\ce {Me3Si}}}{\ce {{Cl}+Na->[{\ ce {Mo / Fe-катализатор}}.] [{\ ce {RT }} \ atop (1 \ {\ ce {atm}})]}} \ {\ color {Red} {\ ce {N}}} {\ color {NavyBlue} {\ ce {(Me3Si) 3}}} }]( https://wikimedia.org/api/rest_v1/media/math/render/svg/6e5a412bc2fab4fa67528a1779b7c318068be6f7 )
Каталитическая производительность катализаторов химической фиксации азота была разработана таким образом Несмотря на интенсивные исследования, все еще намного меньше, чем, например, современные катализаторы полимеризации металлоценового типа или ферменты.