| Субвентрикулярная зона | |
|---|---|
| Идентификаторы | |
| НейроЛекс ID | nlx_144262 |
| Анатомические термины нейроанатомии [ редактировать в Викиданных ] | |
 Субвентрикулярная зона человека. Из статьи Оскара Ариаса-Карриона, 2008 г.
Субвентрикулярная зона человека. Из статьи Оскара Ариаса-Карриона, 2008 г.  В эмбриональном мозге крысы маркер связывания GAD67 имеет тенденцию концентрироваться в субвентрикулярной зоне. Изображение из Popp et al., 2009.
В эмбриональном мозге крысы маркер связывания GAD67 имеет тенденцию концентрироваться в субвентрикулярной зоне. Изображение из Popp et al., 2009. Субвентрикулярная зона ( SVZ) является областью, расположенной на наружной стенке каждого бокового желудочка от позвоночного мозга. Он присутствует как в эмбриональном, так и во взрослом мозге. В эмбриональной жизни SVZ относится к вторичной пролиферативной зоне, содержащей нейральные клетки-предшественники, которые делятся с образованием нейронов в процессе нейрогенеза. Первичные нервные стволовые клетки головного и спинного мозга, называемые радиальными глиальными клетками, вместо этого находятся в желудочковой зоне (VZ) (так называемой, потому что VZ выстилает внутреннюю часть развивающихся желудочков ).
В развивающейся коре головного мозга, которая находится в спинном мозге, SVZ и VZ являются временными тканями, которые не существуют у взрослых. Однако SVZ брюшного конечного мозга сохраняется на протяжении всей жизни. Взрослый SVZ состоит из четырех отдельных слоев переменной толщины и плотности клеток, а также клеточного состава. Наряду с зубчатыми извилинами в гиппокампе, СВЗ является одним из двух мест, где нейрогенез был установлен, что происходит в мозге взрослых млекопитающих. Нейрогенез SVZ взрослых принимает форму нейробластов- предшественников интернейронов, которые мигрируют в обонятельную луковицу через ростральный миграционный поток. SVZ также, по-видимому, участвует в образовании астроцитов после травмы головного мозга.
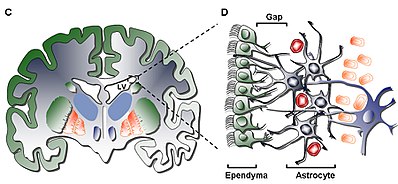
Самый внутренний слой (слой I) содержит единственный слой (монослой) эпендимных клеток, выстилающих полость желудочка; эти клетки обладают апикальными ресничками и несколькими базальными расширениями, которые могут располагаться либо параллельно, либо перпендикулярно поверхности желудочков. Эти расширения могут тесно взаимодействовать с астроцитарными процессами, которые связаны с гипоцеллюлярным слоем (слой II).
Вторичный слой (слой II) обеспечивает гипоцеллюлярную щель, примыкающую к первому, и, как было показано, содержит сеть функционально коррелированных глиальных фибриллярных кислотных белков ( GFAP ) -положительных астроцитарных процессов, которые связаны с соединительными комплексами, но не имеют клеточных тел, за исключением редкие нейрональные соматы. Хотя функция этого слоя у людей еще неизвестна, была выдвинута гипотеза, что астроцитарные и эпендимные взаимосвязи слоев I и II могут действовать, регулируя функции нейронов, устанавливая метаболический гомеостаз и / или контролируя пролиферацию и дифференцировку нейрональных стволовых клеток во время развития.. Потенциально такие характеристики слоя могут действовать как остаток от раннего периода развития или как путь клеточной миграции, учитывая сходство с гомологичным слоем в SVZ крупного рогатого скота, которое, как было показано, имеет мигрирующие клетки, общие только для млекопитающих более высокого порядка.
Третий слой (слой III) образует ленту тел клеток астроцитов, которые, как полагают, поддерживают субпопуляцию астроцитов, способных пролиферировать in vivo и формировать мультипотентные нейросферы со способностью к самообновлению in vitro. Хотя внутри ленты были обнаружены некоторые олигодендроциты и эпендимные клетки, они не только выполняют неизвестную функцию, но и необычны по сравнению с популяцией астроцитов, которые находятся в слое. С помощью электронной микроскопии астроциты, присутствующие в слое III, можно разделить на три популяции, при этом уникальные функции еще не определены; первый тип - это небольшие астроциты с длинными горизонтальными тангенциальными выступами, которые в основном встречаются в слое II; второй тип находится между слоями II и III, а также внутри ленты астроцитов, характеризующейся большим размером и множеством органелл; третий тип обычно находится в боковых желудочках чуть выше гиппокампа и похож по размеру на второй тип, но содержит мало органелл.
Четвертый и последний слой (слой IV) служит переходной зоной между слоем III с его лентой астроцитов и паренхимой головного мозга. Это определяется по высокому содержанию миелина в этом регионе.
В SVZ описаны четыре типа ячеек:
1. Ресничные эпендимальные клетки (тип E): расположены напротив просвета желудочка и функционируют для циркуляции спинномозговой жидкости.
2. Пролиферирующие нейробласты (тип A): экспрессируют PSA-NCAM ( NCAM1 ), Tuj1 ( TUBB3 ) и Hu и мигрируют в линейном порядке к обонятельной луковице.
3. Медленно пролиферирующие клетки (тип B): экспрессируют нестин и GFAP и действуют, чтобы удерживать мигрирующие нейробласты типа A.
4. Активно пролиферирующие клетки или предшественники, усиливающие транзит (тип C): экспрессируют нестин и образуют кластеры, расположенные между цепями по всей области.
SVZ является известным участком нейрогенеза и самообновления нейронов в мозге взрослого человека, который служит таковым благодаря взаимодействующим типам клеток, внеклеточным молекулам и локализованной эпигенетической регуляции, способствующей такой клеточной пролиферации. Наряду с субгранулярной зоной из зубчатой извилины, субвентрикулярная зона служит в качестве источника нервных стволовых клеток (NSC,) в процессе взрослого нейрогенеза. Он является местом обитания самой большой популяции пролиферирующих клеток во взрослом мозге грызунов, обезьян и людей. В 2010 году было показано, что баланс между нервными стволовыми клетками и нейральными клетками-предшественниками (NPCs) поддерживается за счет взаимодействия между сигнальным путем рецептора эпидермального фактора роста и сигнальным путем Notch.
Хотя это еще не было глубоко изучено в человеческом мозге, функция SVZ в мозге грызунов в определенной степени исследована и определена на предмет ее возможностей. С помощью таких исследований было обнаружено, что астроцит с двойным функционированием является доминирующей клеткой в SVZ грызунов; этот астроцит действует не только как нейрональная стволовая клетка, но и как поддерживающая клетка, которая способствует нейрогенезу посредством взаимодействия с другими клетками. Эта функция также индуцируется микроглией и эндотелиальными клетками, которые совместно взаимодействуют со стволовыми клетками нейронов, чтобы способствовать нейрогенезу in vitro, а также компонентами внеклеточного матрикса, такими как тенасцин-C (помогает определить границы взаимодействия) и Lewis X (связывает факторы роста и передачи сигналов). к нейронным предшественникам). Однако человеческий SVZ отличается от SVZ грызунов двумя отличительными чертами; во-первых, астроциты человека не находятся в непосредственном соседстве с эпендимным слоем, а скорее разделены слоем, в котором отсутствуют клеточные тела; во-вторых, в SVZ человека отсутствуют цепи мигрирующих нейробластов, наблюдаемые в SVZ грызунов, что, в свою очередь, обеспечивает меньшее количество нейрональных клеток у человека, чем у грызунов. По этой причине, хотя SVZ грызунов оказывается ценным источником информации о SVZ и его взаимосвязи между структурой и функцией, человеческая модель окажется существенно иной.
Эпигенетические модификации ДНК играют центральную роль в регуляции экспрессии генов во время дифференцировки нервных стволовых клеток. Превращение цитозина в 5-метилцитозин (5mC) в ДНК с помощью ДНК-метилтрансферазы DNMT3A, по-видимому, является важным типом эпигенетической модификации, происходящей в SVZ.
Кроме того, некоторые современные теории предполагают, что SVZ может также служить местом пролиферации стволовых клеток опухоли головного мозга (BTSC), которые похожи на нервные стволовые клетки по своей структуре и способности дифференцироваться в нейроны, астроциты и олигодендроциты. Исследования подтвердили, что небольшая популяция BTSC может не только вызывать опухоли, но и поддерживать их за счет врожденных способностей к самообновлению и мультипотентности. Хотя это не позволяет сделать вывод о том, что BTSC возникают из нервных стволовых клеток, возникает интересный вопрос о взаимосвязи, существующей между нашими собственными клетками и теми, которые могут причинить такой большой ущерб.
В настоящее время существует множество различных аспектов SVZ, изучаемых отдельными лицами в государственном и частном секторах. Такие исследовательские интересы варьируются от роли SVZ в нейрогенезе, направленной миграции нейронов до ранее упомянутого туморогенеза, а также многих других. Ниже приведены краткие сведения о работе трех различных лабораторных групп, сосредоточенных в первую очередь на одном аспекте SVZ; они включают роль SVZ в замене клеток после травмы головного мозга, моделирование пролиферации NSC и роль в различных онкогенных раковых заболеваниях.
В своем обзоре Romanko et al. охарактеризовано влияние острой черепно-мозговой травмы на СВЗ. В целом авторы определили, что умеренное оскорбление СВЗ позволило выздороветь, в то время как более тяжелые травмы нанесли непоправимый ущерб региону. Кроме того, популяция нервных стволовых клеток в SVZ, вероятно, ответственна за эту реакцию на повреждение.
Воздействие облучения на СВЗ, обеспечиваемое для распознавания количества или дозы облучения, которое может быть дано, определяется в основном переносимостью нормальных клеток вблизи опухоли. Как описано, увеличивающаяся доза радиации и возраст приводили к уменьшению трех типов клеток SVZ, но репарационная способность SVZ наблюдалась, несмотря на отсутствие некроза белого вещества ; это произошло, вероятно, потому, что SVZ смог постепенно заменить нейроглию головного мозга. Химиотерапевтические препараты также проверялись на их влияние на SVZ, поскольку они в настоящее время используются при многих заболеваниях, но приводят к осложнениям в центральной нервной системе. Для этого метотрексат (MTX) использовался отдельно и в сочетании с радиацией, и было обнаружено, что примерно 70% общей ядерной плотности SVZ истощено, но, учитывая потерю нейробластов ( клеток- предшественников ), было замечательно обнаружить что НСК SVZ будут по-прежнему генерировать нейросферы, аналогичные тем, которые не получали такого лечения. Что касается прерывания кровоснабжения головного мозга, церебральная гипоксия / ишемия (H / I) также снижает количество клеток SVZ на 20%, при этом 50% нейронов в полосатом теле и неокортексе разрушаются, но Типы клеток убитых SVZ были столь же неоднородными, как и сама область. При последующем тестировании было обнаружено, что другая часть каждой клетки была удалена, но медиальная популяция SVZ-клеток оставалась в основном живой. Это может обеспечить определенную устойчивость таких клеток, при этом незафиксированные клетки-предшественники действуют как пролиферирующая популяция после ишемии. Механическое повреждение головного мозга также вызывает миграцию и пролиферацию клеток, как это наблюдалось у грызунов, и может также увеличивать количество клеток, опровергая ранее существовавшее представление о том, что новые нейрональные клетки не могут образоваться.
В заключение, эта группа смогла определить, что клетки в SVZ способны продуцировать новые нейроны и глию на протяжении всей жизни, учитывая, что они не страдают от повреждений, поскольку чувствительны к любым вредным эффектам. Следовательно, SVZ может восстанавливаться после легкой травмы и потенциально обеспечивать заместительную клеточную терапию для других пораженных областей мозга.
В попытке охарактеризовать и проанализировать механизм, касающийся пролиферации нейрональных клеток в субвентрикулярной зоне, Decressac et al. наблюдали пролиферацию нервных предшественников в субвентрикулярной зоне мыши посредством инъекции нейропептида Y (NPY). NPY представляет собой обычно экспрессируемый белок центральной нервной системы, который, как ранее было показано, стимулирует пролиферацию нейрональных клеток в обонятельном эпителии и гиппокампе. В пептидных эффектах «сек наблюдались через BrdU маркировки и клетки фенотип, что представило доказательство для миграции нейробластов через ростральный миграционный поток к обонятельной луковице (предыдущие эксперименты, подтверждающей) и в стриатум. Такие данные подтверждают гипотезу автора о том, что нейрогенез будет стимулироваться введением такого пептида.
Поскольку NPY представляет собой пептид из 36 аминокислот, связанный со многими физиологическими и патологическими состояниями, он имеет множество рецепторов, которые широко экспрессируются в развивающемся и зрелом мозге грызунов. Однако, учитывая исследования in vivo, проведенные этой группой, рецептор Y1 проявлял специфически опосредованные нейропролиферативные эффекты за счет индукции NPY с повышенной экспрессией в субвентрикулярной зоне. Идентификация рецептора Y1 также проливает свет на тот факт, что фенотип экспрессируемых клеток в результате таких митотических событий на самом деле является клетками типа DCX + ( нейробласты, которые мигрируют непосредственно в полосатое тело ). Наряду с эффектами инъекции NPY на параметры дофамина в полосатом теле, ГАМК и глутамата для регулирования нейрогенеза в субвентрикулярной зоне (предыдущее исследование), это открытие все еще рассматривается, поскольку оно может быть вторичным модулятором вышеупомянутых нейротрансмиттеров.
Как это необходимо для всех исследований, эта группа провела свои эксперименты с широкой перспективой применения своих результатов, которые, как они утверждали, могут потенциально принести пользу потенциальным кандидатам на эндогенное восстановление мозга за счет стимуляции пролиферации нервных стволовых клеток субвентрикулярной зоны. Эта естественная молекулярная регуляция нейрогенеза у взрослых может быть дополнена терапией подходящими молекулами, такими как тестируемый рецептор NPY и Y1, в дополнение к фармакологическим производным для обеспечения управляемых форм нейродегенеративных нарушений в полосатом теле.
В попытке охарактеризовать роль субвентрикулярной зоны в потенциальном онкогенезе Quinones-Hinojosa et al. обнаружили, что стволовые клетки опухоли головного мозга (BTSC) представляют собой стволовые клетки, которые можно выделить из опухолей головного мозга с помощью аналогичных анализов, используемых для нейрональных стволовых клеток. При формировании клональных сфер, подобных нейросферам нейрональных стволовых клеток, эти BTSC были способны дифференцироваться в нейроны, астроциты и олигодендроциты in vitro, но, что более важно, способны инициировать опухоли при низких концентрациях клеток, обеспечивая способность к самообновлению. Поэтому было высказано предположение, что небольшая популяция BTSC с такими способностями к самообновлению поддерживала опухоли при таких заболеваниях, как лейкемия и рак груди.
Несколько характерных факторов приводят к предложенной идее о нейрональных стволовых клетках (NSC) как о происхождении BTSC, поскольку они имеют несколько общих черт. Эти особенности показаны на рисунке.
Эта группа предоставляет доказательства очевидной роли SVZ в онкогенезе, что демонстрируется наличием митогенных рецепторов и их ответом на митогенную стимуляцию, в частности, клетки типа C, которые экспрессируют рецептор эпидермального фактора роста (EGFR), что делает их высоко пролиферативными и инвазивными. Кроме того, было обнаружено, что наличие микроглии и эндотелиальных клеток внутри SVZ усиливает нейрогенез, а также обеспечивает некоторую направленную миграцию нейробластов из SVZ.
Недавно SVZ человека была охарактеризована у пациентов с опухолями головного мозга на фенотипическом и генетическом уровне. Эти данные показывают, что у половины пациентов SVZ является точным местом онкогенеза, тогда как у остальных пациентов он представляет собой инфильтрированную область. Таким образом, вполне возможно, что у людей существует взаимосвязь между образованием NSC в этой области и постоянно самообновляющимися клетками первичных опухолей, которые уступают место вторичным опухолям после удаления или облучения.
Хотя еще предстоит определенно доказать, являются ли стволовые клетки SVZ клеткой происхождения опухолей головного мозга, таких как глиомы, существуют убедительные доказательства, свидетельствующие о повышенной агрессивности опухоли и смертности у тех пациентов, чьи глиомы высокой степени инфильтрируют или контактируют с SVZ.
При раке простаты нейрогенез, индуцированный опухолью, характеризуется привлечением нейральных клеток-предшественников (NPC) из SVZ. NPC проникают в опухоль, где они дифференцируются в вегетативные нейроны (в основном адренергические нейроны), которые стимулируют рост опухоли.