| Протамин 1 | |
|---|---|
| Идентификаторы | |
| Символ | PRM1 |
| Ген NCBI | 5619 |
| HGNC | 9447 |
| OMIM | 182880 |
| RefSeq | NM_002761 |
| UniProt | P04553 |
| Прочие данные | |
| Locus | Chr. 16 p13.13 |
| Протамин 2 | |
|---|---|
| Идентификаторы | |
| Символ | PRM2 |
| Ген NCBI | 5620 |
| HGNC | 9448 |
| OMIM | 182890 |
| RefSeq | NM_002762 |
| UniProt | P04554 |
| Прочие данные | |
| Locus | Chr. 16 p13.13 |
Протамины небольшие, аргинин -богатые, ядерные белки, заменяющие гистоны на поздних стадиях гаплоидной фазы сперматогенеза и, как полагают, необходимы для конденсации головки сперматозоидов и стабилизации ДНК. Они могут позволить более плотную упаковку ДНК в сперматозоиде, чем гистоны, но их необходимо декомпрессировать, прежде чем генетические данные можно будет использовать для синтеза белка. Однако у людей и, возможно, других приматов 10-15% генома сперматозоидов упаковано гистонами, которые, как считается, связывают гены, которые необходимы для раннего эмбрионального развития.
Протамин и протаминоподобные (PL) белки входят в число сперма (SNBP). Белки PL занимают промежуточное положение по структуре между протамином и гистоном H1, C-конец которого является предшественником протамина позвоночных.
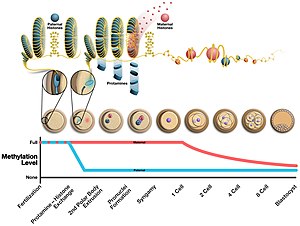 Изменения эпигенома после оплодотворение. Верхняя часть изображения показывает замену протаминов гистонами в отцовском пронуклеусе вскоре после оплодотворения. ДНК, упакованная с протаминами, образует структуры в форме тороида, показанные в верхнем левом углу изображения.
Изменения эпигенома после оплодотворение. Верхняя часть изображения показывает замену протаминов гистонами в отцовском пронуклеусе вскоре после оплодотворения. ДНК, упакованная с протаминами, образует структуры в форме тороида, показанные в верхнем левом углу изображения. Во время образования сперматозоидов протамин связывается с фосфатным остовом ДНК, используя богатый аргинином домен в качестве якоря. Затем ДНК сворачивается в тороид, O-образную структуру, хотя механизм неизвестен. Сперматозоид может содержать до 50 000 тороидальных структур в своем ядре, причем каждый тороид содержит около 50 килобаз. Перед формированием тороида гистоны удаляются из ДНК переходными ядерными белками, так что протамин может его конденсировать. Эффектом этого изменения является 1) увеличение гидродинамики сперматозоидов для лучшего прохождения через жидкости за счет уменьшения размера головки 2) уменьшение частоты повреждений ДНК 3) удаление эпигенетических маркеров, возникающих при модификациях гистонов.
Структура головки сперматозоида также связана с уровнем протамина. Было обнаружено, что отношение протамина 2 к протамину 1 и переходным ядерным белкам изменяет форму головки сперматозоида у различных видов мышей, изменяя экспрессию протамина 2 посредством мутаций в его промоторной области. Было обнаружено, что уменьшение соотношения увеличивает конкурентоспособность сперматозоидов у видов Mus. Однако требуется дальнейшее тестирование, чтобы определить, как это соотношение влияет на форму головы и влияет ли моногамия на этот выбор. Исследования показывают, что у людей мужчины с несбалансированным Prm1 / Prm2 являются субфертильными или бесплодными. Протамин 2 кодируется как более длинный белок, который требует расщепления на N-конце, прежде чем он станет функциональным. Протамин человека и шимпанзе претерпел быструю эволюцию.
При смешивании с инсулином протамины замедляют начало и увеличивают продолжительность действия инсулина (см. инсулин НПХ ).
Протамин используется в кардиохирургии, сосудистой хирургии и в процедурах интервенционной радиологии для нейтрализации антикоагулянтного действия гепарина. Побочные эффекты включают повышение давления в легочной артерии и снижение периферического кровяного давления, потребление кислорода миокардом, сердечный выброс и частота сердечных сокращений.
Сульфат протамина является антидотом при передозировке гепарином, но может возникнуть тяжелая аллергия. Версия протамина с укороченной цепью также действует как мощный антагонист гепарина, но с заметно снижена антигенность. Первоначально он был получен как смесь, полученная путем расщепления протамина термолизином, но с тех пор была выделена фактическая эффективная пептидная часть VSRRRRRRGGRRRR. Аналог этого пептида также был произведен.
В генной терапии способность сульфата протамина конденсировать плазмидную ДНК вместе с его одобрением Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США сделали его привлекательным кандидатом для увеличения трансдукции. показатели как вирусными, так и невирусными (например, с использованием катионных липосом) опосредованные механизмы доставки.
Протамин можно использовать как лекарство от ожирения. Было показано, что протамин сдерживает увеличение массы тела и липопротеинов низкой плотности у крыс с высоким содержанием жиров. Этот эффект возникает за счет ингибирования активности липазы, фермента, ответственного за переваривание и абсорбцию триацилглицерина, что приводит к уменьшению абсорбции пищевых жиров. Когда крыс лечили протамином, повреждений печени не обнаружено. Однако эмульгирование длинноцепочечных жирных кислот для переваривания и всасывания в тонком кишечнике у людей менее постоянное, чем у крыс, что будет варьировать эффективность протамина как лекарственного средства. Кроме того, человеческие пептидазы могут разлагать протамин с разной скоростью, поэтому необходимы дальнейшие тесты для определения способности протамина предотвращать ожирение у людей.
У мышей, людей и некоторых рыб есть два или несколько различных протаминов, тогда как сперма быка и кабана имеет одну форму протамина из-за мутации в гене PRM2. У крыс, хотя ген PRM2 присутствует, экспрессия этого белка чрезвычайно мала из-за ограниченной транскрипции из-за неэффективного промотора в дополнение к измененному процессингу транскрипта мРНК.
Два человеческих протамина обозначены PRM1 и PRM2.
Примеры протаминов из рыб:
| Протамин P1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Протамин_P1 | ||||||||
| Pfam | PF00260 | ||||||||
| InterPro | IPR000221 | ||||||||
| PROSITE | PDOC00047 | ||||||||
| |||||||||
| Protamine P2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Symbol | Prot amine_P2 | ||||||||
| Pfam | PF00841 | ||||||||
| InterPro | IPR000492 | ||||||||
| |||||||||
Первичная структура протамина P1, протамина, используемого для упаковки ДНК в сперматозоиды, у плацентарных млекопитающих обычно имеет длину 49 или 50 аминокислот. Эта последовательность разделена на три отдельных домена: богатый аргинином домен для связывания ДНК, фланкированный более короткими пептидными последовательностями, содержащими в основном остатки цистеина. Богатый аргинином домен состоит из 3-11 остатков аргинина и является консервативным между последовательностями протамина 1 рыб и протамина 1 млекопитающих при примерно 60-80% идентичности последовательностей. После трансляции структура протамина P1 немедленно фосфорилируется по всем трем из вышеупомянутых доменов. Другой раунд фосфорилирования происходит, когда сперма попадает в яйцеклетку, но функция этого фосфорилирования неясна. Когда протамин P1 связывается с ДНК, цистеин на амино-конце одного протамина P1 образует дисульфидные связи с цистеином на карбокси-конце другого протамина P1. Дисульфидные связи предотвращают диссоциацию протамина P1 от ДНК до тех пор, пока связи не уменьшатся, когда сперматозоид входит в яйцеклетку.
Вторичная и третичная структура протамина достоверно неизвестна, но было опубликовано несколько предложений.