| Термолизин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
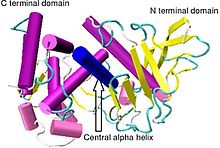 Кристаллографическая структура термолизина Bacillus thermoproteolyticus. Кристаллографическая структура термолизина Bacillus thermoproteolyticus. | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.4.24.27 | ||||||||
| Номер CAS | 9073-78-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG запись | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
термолизин (EC 3.4.24.27, нейтральная протеиназа Bacillus thermoproteolyticus, термоаза, термоаза Y10, TLN) термостабильная нейтральная металлопротеиназа фермент, продуцируемый грамположительными бактериями Bacillus thermoproteolyticus. Требуется один ион цинка для активности фермента и четыре иона кальция для структурной стабильности. Термолизин специфически катализирует гидролиз пептидных связей, содержащих гидрофобные аминокислоты. Однако термолизин также широко используется для образования пептидной связи посредством обратной реакции гидролиза. Термолизин является наиболее стабильным членом семейства металлопротеиназ, продуцируемых различными видами Bacillus. Эти ферменты также называют «нейтральными» протеиназами или термолизин-подобными протеиназами (TLP).
Как все бактериальные внеклеточные протеазы термолизин сначала синтезируется бактериями как препрофермент. Термолизин синтезируется как препрофермент, состоящий из сигнального пептида длиной 28 аминокислот, пропептида длиной 204 аминокислоты и самого зрелого фермента длиной 316 аминокислот. Сигнальный пептид действует как сигнал для транслокации препротермолизина к бактериальной цитоплазматической мембране. Затем в периплазме препротермолизин преобразуется в протермолизин с помощью сигнальной пептидазы. Затем пропоследовательность действует как молекулярный шаперон и приводит к авторасщеплению пептидной связи, связывающей про и зрелые последовательности. Зрелый белок затем секретируется во внеклеточную среду.
Термолизин имеет молекулярную массу 34 600 Да. Его общая структура состоит из двух примерно сферических доменов с глубокой щелью, проходящей через середину молекулы, разделяющей два домена. вторичная структура каждого домена совершенно разная, N-концевой домен состоит в основном из бета-складчатого листа, а C-концевой домен в основном имеет структуру альфа-спирали. Эти два домена связаны центральной альфа-спиралью, охватывающей аминокислоты 137-151.
В отличие от многих белков, которые претерпевают конформационные изменения при нагревании и денатурации, термолизин не претерпевает каких-либо серьезных изменений. конформационные изменения, по крайней мере, до 70 ° C. Термическая стабильность членов семейства TLP измеряется в единицах температуры T 50. Инкубация при этой температуре в течение 30 минут снижает активность ферментов вдвое. Термолизин имеет значение T 50 86,9 ° C, что делает его наиболее термостабильным членом семейства TLP. Исследования вклада кальция в стабильность термолизина показали, что при термической инактивации из молекулы высвобождается единственный ион кальция. Предотвращение первоначального связывания этого кальция с молекулой за счет мутации его сайта связывания снижает стабильность термолизина на 7 ° C. Однако, хотя связывание кальция вносит значительный вклад в стабилизацию термолизина, более важным для стабильности является небольшой кластер аминокислот N-концевого домена, расположенный на поверхности белков. В частности, фенилаланин (F) в положении 63 аминокислоты и пролин (P) в положении 69 аминокислоты в значительной степени способствуют стабильности термолизина. Замена этих аминокислот на треонин (T) и аланин (A) соответственно в менее стабильной термолизиноподобной протеиназе, продуцируемой Bacillus stearothermophillus (TLP-ste), приводит к индивидуальному снижению стабильность 7 ° C (F63 → T) и 6,3 ° C (P69 → A) и в сочетании снижение стабильности на 12,3 ° C.