| Малатдегидрогеназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
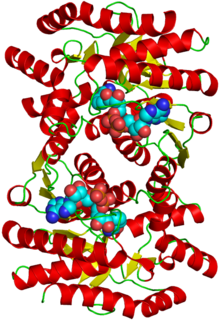 Структура белка с присоединенными кофакторами Структура белка с присоединенными кофакторами | |||||||||
| Идентификаторы | |||||||||
| ЕС нет. | 1.1.1.37 | ||||||||
| № CAS | 9001-64-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Малат - дегидрогеназа ( ЕС 1.1.1.37 ) ( МДГ) представляет собой фермент, который обратимо катализирует к окислению в малате, чтобы оксалоацетат с помощью снижения NAD + к NADH. Эта реакция является частью многих метаболических путей, включая цикл лимонной кислоты. Другие малата дегидрогеназа, которые имеют другие номера EC и катализируют другие реакции окислительных малат, имеет определенные имена, как малат дегидрогеназа (НАДФ +).
Существует несколько изоферментов малатдегидрогеназы. В эукариотических клетках есть две основные изоформы. Один из них находится в матриксе митохондрий и участвует в качестве ключевого фермента в цикле лимонной кислоты, который катализирует окисление малата. Другой находится в цитоплазме, помогая челноку малат-аспартат обмениваться восстанавливающими эквивалентами, так что малат может проходить через митохондриальную мембрану и превращаться в оксалоацетат для дальнейших клеточных процессов.
Люди и большинство других млекопитающих экспрессируют следующие две малатдегидрогеназы:
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||
 Трехмерная кристаллическая структура области подвижной петли в малатдегидрогеназе в закрытой и открытой конформации. Закрытая конформация MDH показана розовым цветом (указана розовой стрелкой), а открытая конформация показана голубым цветом (указана голубой стрелкой).
Трехмерная кристаллическая структура области подвижной петли в малатдегидрогеназе в закрытой и открытой конформации. Закрытая конформация MDH показана розовым цветом (указана розовой стрелкой), а открытая конформация показана голубым цветом (указана голубой стрелкой). Семейство малатдегидрогеназ содержит L-лактатдегидрогеназу и L-2-гидроксиизокапроатдегидрогеназу. L-лактатдегидрогеназа катализирует превращение L-лактата в пируват, последнюю стадию анаэробного гликолиза. N-конец является Rossmann НАД-связывающим сгиба и С-конец является необычным альфа + бета раза.
У большинства организмов малатдегидрогеназа (МДГ) существует в виде гомодимерной молекулы и по структуре тесно связана с лактатдегидрогеназой (ЛДГ). Это большая молекула белка с субъединицами массой от 30 до 35 кДа. Основываясь на аминокислотных последовательностях, кажется, что MDH разделился на две основные филогенетические группы, которые очень похожи либо на митохондриальные изоферменты, либо на изоферменты цитоплазмы / хлоропластов. Поскольку идентичность последовательности малатдегидрогеназы в митохондриях более тесно связана с ее прокариотическими предками по сравнению с цитоплазматическим изоферментом, теория о том, что митохондрии и хлоропласты возникли в результате эндосимбиоза, является правдоподобной. Аминокислотные последовательности архой MDH больше похожи на ЛДГ, чем у MDH других организмов. Это указывает на возможную эволюционную связь между лактатдегидрогеназой и малатдегидрогеназой.
Каждая субъединица димера малатдегидрогеназы имеет два отдельных домена, которые различаются по структуре и функциональности. Параллельная структура β-листов составляет домен связывания NAD +, в то время как четыре β-листа и одна α-спираль составляют центральный сайт связывания NAD +. Субъединицы удерживаются вместе за счет обширных водородных связей и гидрофобных взаимодействий.
Также было показано, что малатдегидрогеназа имеет участок подвижной петли, который играет решающую роль в каталитической активности фермента. Исследования показали, что конформационное изменение этой области петли из открытой конформации в закрытую после связывания субстрата усиливает катализ МДГ за счет защиты субстрата и каталитических аминокислот от растворителя. Исследования также показали, что этот участок петли высоко консервативен в малатдегидрогеназе.
 Активный центр малатдегидрогеназы
Активный центр малатдегидрогеназы Активный центр малатдегидрогеназы представляет собой гидрофобную полость внутри белкового комплекса, которая имеет специфические сайты связывания для субстрата и его кофермента, NAD +. В своем активном состоянии MDH претерпевает конформационное изменение, которое охватывает субстрат, чтобы минимизировать воздействие растворителя и расположить ключевые остатки ближе к субстрату. В частности, три остатка, составляющие каталитическую триаду, - это гистидин (His-195), аспартат (Asp-168), оба из которых работают вместе как система переноса протона, и аргинины (Arg-102, Arg-109, Arg-171), которые закрепляют подложку.
Механически малатдегидрогеназа катализирует окисление гидроксильной группы малата, используя НАД + в качестве акцептора электронов. Эта стадия окисления приводит к удалению протона и иона гидрида с субстрата. НАД + получает ион гидрида (в частности, ион гидрида переносится на никотинамидное кольцо НАД +) и восстанавливается до НАДН, в то время как одновременно остаток His-195 на ферменте принимает протон. Положительно заряженный остаток His-195, который участвует в основном катализе субстрата, стабилизируется соседним отрицательно заряженным остатком Asp-168. Эта электростатическая стабилизация помогает облегчить перенос протона. Arg-102, Arg-109 и Arg-171 (которые протонированы и, следовательно, положительно заряжены) участвуют в электростатическом катализе и помогают связывать отрицательно заряженные карбоксилаты на субстрате. Кроме того, остатки аргинина на ферменте обеспечивают дополнительную субстратную специфичность и связывание за счет водородной связи между гуанидиниевой боковой цепью аминокислотных остатков аргинина и карбоксилатами субстрата.
Исследования также выявили подвижную петлю в малатдегидрогеназе, которая участвует в каталитической активности фермента. Петля претерпевает конформационные изменения, чтобы защитить субстрат и каталитические аминокислоты от растворителя в ответ на связывание комплекса малатдегидрогеназа: кофермент с субстратом. Это переворачивание петли в верхнее положение для покрытия активного центра также способствует усиленному взаимодействию каталитически важных аминокислотных остатков фермента с субстратом. Кроме того, было показано, что движение петли коррелирует с этапом определения скорости фермента.
 Общая реакция, показывающая катализируемое малатдегидрогеназой окисление малата посредством восстановления NAD +.
Общая реакция, показывающая катализируемое малатдегидрогеназой окисление малата посредством восстановления NAD +. Малатдегидрогеназа катализирует взаимное превращение малата в оксалоацетат. В цикле лимонной кислоты малатдегидрогеназа отвечает за катализ регенерации оксалоацетата. Эта реакция происходит за счет окисления гидроксильной группы малата и восстановления NAD +. Механизм переноса иона гидрида на NAD + осуществляется по аналогичному механизму, наблюдаемому в лактатдегидрогеназе и алкогольдегидрогеназе. ΔG '° малатдегидрогеназы составляет +29,7 кДж / моль, а ΔG (в ячейке) составляет 0 кДж / моль.
Малатдегидрогеназа также участвует в глюконеогенезе, синтезе глюкозы из более мелких молекул. Пируват в митохондриях подвергается действию пируваткарбоксилазы с образованием оксалоацетата, промежуточного соединения цикла лимонной кислоты. Чтобы получить оксалоацетат из митохондрий, малатдегидрогеназа восстанавливает его до малата, а затем он проходит через внутреннюю мембрану митохондрий. Попав в цитозоль, малат снова окисляется до оксалоацетата цитозольной малатдегидрогеназой. Наконец, фосфоенолпируваткарбоксикиназа (PEPCK) превращает оксалоацетат в фосфоенолпируват (PEP).
Кинетические исследования показывают, что ферментативная активность малатдегидрогеназы упорядочена. Кофактор НАД + / НАДН связывается с ферментом раньше субстрата. Значение Km для малата, т. Е. Концентрация, при которой активность фермента является полумаксимальной, составляет 2 мМ. Значение Kcat составляет 259,2 с -1.
Кроме того, уровни pH контролируют специфичность связывания субстрата малатдегидрогеназой из-за переноса протона в каталитическом механизме. Было высказано предположение, что гистидиновый фрагмент со значением pK 7,5 играет роль в pH-зависимости фермента. Исследования показали, что связывание оксалоацетата енольной формы с малатдегидрогеназой: комплекс НАДН образуется намного быстрее при более высоких значениях pH. Кроме того, связывание L-малата с малатдегидрогеназой усиливается в щелочных условиях. Следовательно, непротонированная форма малатдегидрогеназы связывается преимущественно с L-малатом и енольной формой оксалоацетата. Напротив, было обнаружено, что D-малат, гидроксималонат и кетоформа оксалоацетата связываются исключительно с протонированной формой фермента. В частности, когда гистидин протонирован, остаток His может образовывать водородную связь с карбонильным кислородом субстрата, что смещает электронную плотность от кислорода и делает его более восприимчивым к нуклеофильной атаке гидрида. Это способствует связыванию малатдегидрогеназы с этими субстратами. В результате при более низких значениях pH малатдегидрогеназа связывается преимущественно с D-малатом, гидроксималонатом и кетооксалоацетатом.
Поскольку малатдегидрогеназа тесно связана с циклом лимонной кислоты, исследования предложили и экспериментально продемонстрировали, что цитрат является аллостерическим регулятором малатдегидрогеназы в зависимости от концентраций L-малата и NAD +. Это может быть связано с отклонениями, наблюдаемыми в кинетическом поведении малатдегидрогеназы при высоких концентрациях оксалоацетата и L-малата. Эксперименты показали, что цитрат может аллостерически активировать и ингибировать ферментативную активность малатдегидрогеназы. Было показано, что цитрат ингибирует окисление L-малата при низких уровнях L-малата и NAD +. Однако в присутствии высоких уровней малата и НАД + цитрат может стимулировать выработку оксалоацетата. Хотя малатдегидрогеназа обычно считается обратимым ферментом, считается, что на ферменте существует аллостерический регуляторный сайт, с которым цитрат может связываться и управлять равновесием реакции в любом направлении.
Было также показано, что глутамат подавляет активность малатдегидрогеназы. Кроме того, было показано, что альфа-кетоглутаратдегидрогеназа может взаимодействовать с митохондриальной аспартатаминотрансферазой с образованием комплекса, который затем может связываться с малатдегидрогеназой, образуя тройной комплекс, который отменяет ингибирующее действие глутамата на ферментативную активность малатдегидрогеназы. Кроме того, образование этого комплекса позволяет глутамату реагировать с аминотрансферазой, не влияя на активность малатдегидрогеназы. Образование этого тройного комплекса также способствует высвобождению оксалоацетата из малатдегидрогеназы в аминотрансферазу. Кинетически было показано, что связывание малатдегидрогеназы с бинарным комплексом альфа-кетоглутаратдегидрогеназы и аминотраннферазы увеличивает скорость реакции малатдегидрогеназы, поскольку Km малатдегидрогеназы снижается, когда она связывается как часть этого комплекса.
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.
[[Файл: [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]]
[[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]]  | alt = Гликолиз и глюконеогенез править ]] Гликолиз и глюконеогенез править
| alt = Гликолиз и глюконеогенез править ]] Гликолиз и глюконеогенез править