| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Этандиал | |||
| Другие имена Глиоксаль. Оксальдегид. Оксалальдегид | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.160 | ||
| KEGG | |||
| PubChem CID | |||
| UNII | |||
| CompTox Панель управления (EPA ) | |||
InChI
| |||
УЛЫБКА
| |||
| Свойства | |||
| Химическая формула | C2H2O2 | ||
| Молярная масса | 58,036 г · моль | ||
| Плотность | 1,27 г / см | ||
| Точка плавления | 15 ° C (59 ° F; 288 K) | ||
| Точка кипения | 51 ° C (124 ° F; 324 K) | ||
| Термохимия | |||
| Теплоемкость (C) | 1,044 Дж / (К · г) | ||
| Опасности | |||
| NFPA 704 (огненный алмаз) |  1 2 1 1 2 1 | ||
| Температура вспышки | −4 ° C (2 5 ° F; 269 K) | ||
| самовоспламенение. температура | 285 ° C (545 ° F; 558 K) | ||
| Родственные соединения | |||
| Родственные альдегиды | ацетальдегид. гликолевый альдегид. пропандиаль. метилглиоксаль | ||
| Родственные соединения | глиоксиловая кислота. гликолевая кислота. щавелевая кислота. пировиноградная кислота. диацетил. ацетилацетон | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки ink | |||
Глиоксаль представляет собой органическое соединение с химической формулой OCHCHO. Это наименьший диальдегид (соединение с двумя альдегидными группами). Он представляет собой кристаллическое твердое вещество, белое при низких температурах и желтое около точки плавления (15 ° C). Жидкость желтого цвета, а пар зеленый.
Чистый глиоксаль обычно не встречается, поскольку он образует гидраты, которые олигомеризуются. Для многих целей эти гидратированные олигомеры ведут себя аналогично глиоксалю. Его производят в промышленных масштабах как предшественник многих продуктов.
Глиоксаль был впервые получен и назван немецко-британским химиком Генрихом Дебусом (1824–1915) путем взаимодействия этанола с азотной кислотой.
Коммерческий глиоксаль получают либо газофазным окислением этиленгликоля в присутствие серебра или меди катализатора (процесс Лапорта) или жидкофазным окислением ацетальдегида с азотная кислота.
Первый коммерческий источник глиоксаля был в Ламот, Франция, начат в 1960 году. Самый крупный коммерческий источник - BASF в Людвигсхафене, Германия, около 60 000 тонн в год. Другие производственные площадки существуют также в США и Китае. Коммерческий массовый глиоксаль производится и описывается как раствор в воде с концентрацией 40%.
Глиоксаль можно синтезировать в лаборатории путем окисления ацетальдегида с помощью селенистой кислоты.
Безводный глиоксаль получают путем нагревания твердого гидрата глиоксаля ( s) с пентоксидом фосфора и конденсацией паров в холодной ловушке.
Экспериментально определенная константа закона Генри для глиоксаля составляет:
![{\ displaystyle K _ {\ текст {H}} = 4,19 \ times 10 ^ {5} \ times \ exp \ left [{\ frac {6.22 \ times 10 ^ {4} \, {\ text {kJ}} \, {\ text {mol} } ^ {- 1}} {R}} \ times \ left ({\ frac {1} {T}} - {\ frac {1} {298 \, {\ text {K}}}} \ right) \ справа] \, {\ text {M}} \, {\ text {atm}} ^ {- 1}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/889cc6b8a3cb98f718253ccab840f434f2809fd5)
 Гликация часто влечет за собой модификацию гуанидиновой группы остатки аргинина с глиоксалем (R = H), метилглиоксалем (R = Me) и 3-дезоксиглюкозоном, которые возникают в результате метаболизма продуктов с высоким содержанием углеводов. Модифицированные таким образом эти белки вносят вклад в осложнения диабета.
Гликация часто влечет за собой модификацию гуанидиновой группы остатки аргинина с глиоксалем (R = H), метилглиоксалем (R = Me) и 3-дезоксиглюкозоном, которые возникают в результате метаболизма продуктов с высоким содержанием углеводов. Модифицированные таким образом эти белки вносят вклад в осложнения диабета. Конечные продукты повышенного гликирования (AGE) - это белки или липиды, которые становятся гликированными в результате диеты с высоким содержанием сахара. Они представляют собой биомаркеры, влияющие на старение и развитие или ухудшение многих дегенеративных заболеваний, таких как диабет, атеросклероз, хроническая болезнь почек. болезнь и болезнь Альцгеймера.
мелованная бумага и отделка текстиля используют большие количества глиоксаля в качестве сшивающего агента для составы на основе крахмала. Он конденсируется с мочевиной с образованием 4,5-дигидрокси-2-имидазолидинона, который далее реагирует с формальдегидом с образованием бис (гидроксиметил) производного диметилол, этиленмочевины, который используется для химической обработки одежды, устойчивой к появлению морщин, то есть постоянной печати.
Глиоксаль используется в качестве солюбилизатора и сшивающего агента в химии полимеров.
Глиоксаль является ценным строительным блоком в органическом синтезе, особенно в синтезе гетероциклов, таких как имидазолы. Удобной формой реагента для использования в лаборатории является его бис (полуацеталь) с этиленгликолем, 1,4-диоксан-2,3-диолом. Это соединение имеется в продаже.
Растворы глиоксаля также могут использоваться в качестве фиксатора для гистологии, то есть метода сохранения клеток для исследования их под микроскопом.
Глиоксаль и его производные также используются в химическом исследовании структуры РНК, так как они реагируют со свободными гуанинами в РНК.
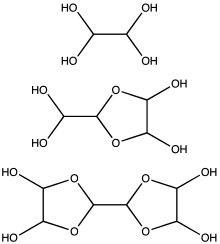 Гидратированный глиоксаль (вверху) и производные олигомеры, называемые димерами и тримерами. Средние и низшие частицы существуют в виде смесей изомеров.
Гидратированный глиоксаль (вверху) и производные олигомеры, называемые димерами и тримерами. Средние и низшие частицы существуют в виде смесей изомеров. Глиоксаль обычно поставляется в виде 40% водного раствора. Как и другие небольшие альдегиды, глиоксаль образует гидраты. Кроме того, гидраты конденсируются с образованием ряда олигомеров, структура некоторых из которых остается неопределенной. Для большинства приложений точная природа частиц в растворе не имеет значения. По крайней мере, один гидрат глиоксаля продается на рынке, дигидрат тримера глиоксаля: [(CHO) 2]3(H2O)2(CAS 4405-13-4). Доступны и другие эквиваленты глиоксаля, такие как полуацеталь этиленгликоля 1,4-диоксан-транс-2,3-диол (CAS 4845-50-5, т.пл. 91–95 ° C),
Предполагается, что при концентрациях менее 1 M глиоксаль существует преимущественно в виде мономера или его гидратов, то есть OCHCHO, OCHCH (OH) 2, или (HO) 2 CHCH (OH) 2. При концентрациях выше 1 М преобладают димеры. Эти димеры, вероятно, представляют собой диоксоланы с формулой [(HO) CH] 2O2CHCHO. Димеры и тримеры осаждаются в виде твердых веществ из холодных растворов.
Глиоксаль был обнаружен как следовой газ в атмосфере, например как продукт окисления углеводородов. Тропосферные концентрации 0–200 ppt по объему, в загрязненных регионах до 1 ppb по объему.
LD50 (перорально, крысы) составляет 3300 мг / кг, что является очень высоким показателем.
Man erhitzt nun das Glyoxal-Phosphorpentoxyd-Gemisch mit freier Flamme und beobachtet bald, dass sich unter Schwarzfärbung des Kolbeninhalte ein flüchtiges grünes Gas bildet, welches sich in der gekühlten Vorlage zu schönen Krystallen von Gelber Farbe kondensiert. представляет собой смесь (сырого) глиоксаля и P 4O10с открытым пламенем, и вскоре после почернения содержимого наблюдается подвижный зеленый газ, который конденсируется в охлажденной колбе в виде красивых желтых кристаллов.]