 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Fotivda |
| Другие названия | AV-951 |
| AHFS / Drugs.com | UK Drug Information |
| Пути. введения | Внутрь |
| Код ATC | |
| Правовой статус | |
| Правовой статус |
|
| Фармакокинетические данные данные | |
| Белок связывание | >99% |
| Период полувыведения | 4,5–5,1 дня |
| Экскреция | 79% фекалии, 12% моча |
| Идентификаторы | |
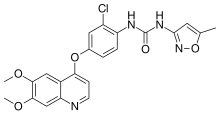
Название IUPAC
| |
| Номер CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL |
|
| CompTox Dashboard (EPA ) | |
| Химические и физические данные | |
| Для mula | C22H19ClN 4O5 |
| Молярная масса | 454,87 г · моль |
| 3D-модель (JSmol ) | |
SMILES
| |
InChI
| |
Тивозаниб (торговое название Fotivda ) является пероральным рецептор VEGF ингибитор тирозинкиназы. Он завершил Фазу 3 исследования лечения пациентов первой линии (ранее не получавших лечения) с почечно-клеточной карциномой. Результаты этого исследования первой линии не привели к утверждению FDA США, но тивозаниб был одобрен Европейским агентством по лекарственным средствам (EMA) в августе 2017 года.
Тивозаниб нельзя сочетать с зверобоем. Зверобой, индуктор печеночного фермента CYP3A4 (см. Взаимодействия ниже). Его не следует принимать во время беременности, так как он тератоген, эмбриотоксичен и фетотоксичен для крыс.
Наиболее частыми побочными эффектами в исследованиях были артериальная гипертензия. (высокое кровяное давление, у 48% пациентов), дисфония (хриплый голос, 27%), утомляемость и диарея (оба 26%). гипертонический криз возник у 1% пациентов.
Введение однократной дозы тивозаниба с рифампицином, сильным индуктором Фермент CYP3A4 вдвое сокращает биологический период полувыведения и общее воздействие (AUC ) тивозаниба, но не оказывает существенного влияния на самые высокие концентрации в крови. Комбинация с кетоконазолом, сильным ингибитором CYP3A4, не оказывает значимого воздействия. Клиническая значимость этих результатов неизвестна.
A хинолин производное мочевины, тивозаниб подавляет ангиогенез за счет избирательного ингибирования фактора роста эндотелия сосудов. Он был разработан. Он разработан для ингибирования всех трех рецепторов VEGF.
После приема тивозаниба через рот самые высокие уровни в сыворотке крови достигаются через 2–24 часа. Общая AUC не зависит от приема пищи. Находясь в кровотоке, более 99% вещества связывается с белками плазмы, преимущественно с альбумином. Хотя ферменты CYP3A4 и CYP1A1 и несколько UGT способны метаболизировать лекарство, более 90% циркулируют в неизмененном виде. Метаболиты представляют собой продукты деметилирования, гидроксилирования и N-окисления и глюкурониды.
. Биологический период полувыведения составляет от 4,5 до 5,1 дня; 79% выводится с калом, в основном в неизмененном виде, и 12% с мочой, полностью в неизмененном виде.
Тивозаниб используется в форме гидрохлорид моногидрат, который представляет собой порошок от белого до светло-коричневого цвета. Он практически нерастворим в воде и имеет низкую растворимость в водных кислотах, этаноле и метаноле. Он не гигроскопичен и не оптически активен.
Результаты фазы III распространенной почечно-клеточной карциномы показали улучшение медианы прогрессирования на 30% или 3 месяца -свободная выживаемость по сравнению с сорафенибом, но показала более низкую общую выживаемость экспериментальной группы по сравнению с контрольной группой. В мае 2013 года Консультативный комитет по онкологическим препаратам Управления по контролю за продуктами и лекарствами проголосовал 13 против 1 против рекомендации одобрения тивозаниба при почечно-клеточной карциноме. Комитет посчитал, что препарат не продемонстрировал благоприятного соотношения риск-польза, и поставил под сомнение уравновешенность дизайна исследования, которая позволяла пациентам контрольной группы, которые использовали сорафениб, перейти на тивозаниб после прогрессирования заболевания, но не тем, кто участвовал в экспериментальной группе. рука с тивозанибом для перехода на сорафениб. Заявка была официально отклонена FDA в июне 2013 года, заявив, что для утверждения потребуются дополнительные клинические исследования.
В 2016 году AVEO Oncology опубликовала данные совместно с совещанием ASCO, показав влияние географического положения об общей выживаемости в исследовании фазы III.
В 2016 году компания AVEO Oncology объявила о начале второго клинического исследования фазы III у пациентов с распространенным ПКР третьей линии.
В 2016 году объявили о запуске EUSA Pharma и AVEO Oncology. что тивозаниб был передан на рассмотрение в Европейское агентство по лекарственным средствам в рамках централизованной процедуры.
В июне 2017 года Научный комитет EMA рекомендовал тивозаниб для утверждения в Европе, одобрение ожидается в сентябре.
В августе 2017 года Европейская комиссия (ЕК) официально одобрила тивозаниб в Европе.