Терминальная дезоксинуклеотидилтрансфераза (TdT ), также известная как ДНК-нуклеотидиллексотрансфераза (DNTT ) или терминальная трансфераза, представляет собой специализированную ДНК-полимеразу, экспрессируемую в незрелых, пре-B, пре-T лимфоидных клетках и острый лимфобластный лейкоз / лимфомные клетки. TdT добавляет N-нуклеотидов к V, D и J экзонам генов TCR и BCR во время рекомбинации гена антитела, что позволяет феномен разнообразия соединений. У человека терминальная трансфераза кодируется геном DNTT . Являясь членом X-семейства ферментов ДНК-полимеразы, он работает вместе с полимеразой λ и полимеразой μ, которые принадлежат к одному и тому же X-семейству полимеразных ферментов. Разнообразие, внесенное TdT, сыграло важную роль в эволюции иммунной системы позвоночных, значительно увеличив количество рецепторов антигена, которыми оснащена клетка для борьбы с патогенами. Исследования с использованием мышей, нокаутированных по TdT, обнаружили резкое снижение (в 10 раз) разнообразия Т-клеточного рецептора (TCR) по сравнению с таковым в системах нормального или дикого типа. Большее разнообразие TCR, которыми оснащен организм, приводит к большей устойчивости к инфекции. Хотя TdT была одной из первых ДНК-полимераз, выявленных у млекопитающих в 1960 году, она остается одной из наименее изученных из всех ДНК-полимераз. В 2016–2018 годах было обнаружено, что TdT демонстрирует транс-матричное зависимое поведение в дополнение к его более широко известному шаблонно-независимому поведению
TdT отсутствует в печени плода HSC, что значительно ухудшает функциональное разнообразие в В-клетках во время плода.
Как правило, TdT катализирует добавление нуклеотидов к 3'-концу молекулы ДНК. В отличие от большинства ДНК-полимераз, он не требует матрицы. Предпочтительным субстратом этого фермента является 3'-выступ, но он также может добавлять нуклеотиды к тупым или утопленным 3'-концам. Кроме того, TdT является единственной полимеразой, которая, как известно, катализирует синтез 2-15нт полимеров ДНК из свободных нуклеотидов в растворе in vivo. In vitro такое поведение катализирует общее образование полимеров ДНК без определенной длины. Предполагается, что 2-15nt фрагменты ДНК, полученные in vivo, действуют в сигнальных путях, связанных с аппаратом репарации и / или рекомбинации ДНК. Как и многие полимеразы, TdT требует двухвалентного катиона кофактора, однако TdT уникален своей способностью использовать более широкий диапазон катионов, таких как Mg2 +, Mn2 +, Zn2 + и Co2 +. Скорость ферментативной активности зависит от доступных двухвалентных катионов и добавляемого нуклеотида.
TdT экспрессируется в основном в первичных лимфоидных органах, таких как тимус и костный мозг. Регуляция его экспрессии происходит несколькими путями. К ним относятся белок-белковые взаимодействия, например, с TdIF1. TdIF1 - еще один белок, который взаимодействует с TdT, подавляя его функцию, маскируя ДНК-связывающую область полимеразы TdT. Регуляция экспрессии TdT также существует на уровне транскрипции, при этом регуляция зависит от стадийно-специфических факторов и происходит ограничивающим с точки зрения развития образом. Хотя обычно обнаруживается, что экспрессия происходит в первичных лимфоидных органах, недавние исследования показали, что стимуляция с помощью антигена может приводить к вторичной экспрессии TdT наряду с другими ферментами, необходимыми для перестройки генов за пределами тимуса для Т-клеток. Пациенты с острым лимфобластным лейкозом сильно продуцируют TdT. Клеточные линии, полученные от этих пациентов, послужили одним из первых источников чистого TdT и привели к открытию того, что существуют различия в активности между изоформами человека и крупного рогатого скота.
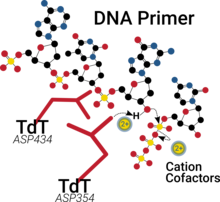 График, описывающий механизм конденсации нуклеотидила с оцДНК, катализируемая терминальной дезоксинуклеотидилтрансферазой с кофакторами двухвалентных катионов. Два остатка аспартата способствуют связыванию катионов и нуклеофильной атаке.
График, описывающий механизм конденсации нуклеотидила с оцДНК, катализируемая терминальной дезоксинуклеотидилтрансферазой с кофакторами двухвалентных катионов. Два остатка аспартата способствуют связыванию катионов и нуклеофильной атаке.Подобно многим полимеразам, каталитический сайт TdT имеет два двухвалентных катиона в его пальмовом домене, которые способствуют связыванию нуклеотидов, помогают снизить pK a 3'-OH группы и, в конечном итоге, способствуют удалению образующегося побочного продукта пирофосфата.
Несколько изоформ TdT наблюдались у мышей, крупного рогатого скота и человека. На сегодняшний день у мышей идентифицировано два варианта, а у людей - три.
Два варианта сплайсинга, идентифицированные у мышей, названы в соответствии с их соответствующей длиной: TdTS состоит из 509 аминокислот, тогда как TdTL - более длинный. вариант, состоит из 529 аминокислот. Различия между TdTS и TdTL происходят вне областей, связывающих ДНК и нуклеотиды. То, что разница в 20 аминокислот влияет на ферментативную активность, является спорным: некоторые утверждают, что модификации TdTL обеспечивают экзонуклеазную активность, в то время как другие утверждают, что TdTL и TdTS имеют почти идентичную активность in vitro. Кроме того, сообщается, что TdTL может модулировать каталитическую активность TdTS in vivo посредством неизвестного механизма. Предполагается, что это помогает в регуляции роли TdT в рекомбинации V (D) J.
Изоформы TdT человека имеют три варианта: TdTL1, TdTL2 и TdTS. TdTL1 широко экспрессируется в линиях лимфоидных клеток, тогда как TdTL2 преимущественно экспрессируется в нормальных малых лимфоцитах. Оба они локализуются в ядре при экспрессии и оба обладают экзонуклеазной активностью 3 '->5'. Напротив, изоформы TdTS не обладают экзонуклеазной активностью и выполняют необходимое удлинение во время рекомбинации V (D) J. Поскольку аналогичная экзонуклеазная активность, предположенная в TdTL мышей, обнаружена в TdTL человека и крупного рогатого скота, некоторые постулируют, что изоформы TdTL быка и человека регулируют изоформы TdTS таким же образом, как предполагалось для мышей. Кроме того, некоторые предполагают, что TdTL1 может участвовать в регуляции активности TdTL2 и / или TdTS.
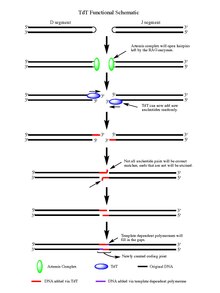 Это изображение дает визуальное представление о том, как TdT работает в процессе перестройки гена антитела. Знайте, что хотя на изображении используются сегменты D и J, такой же тип перестройки происходит и с другими парами сегментов.
Это изображение дает визуальное представление о том, как TdT работает в процессе перестройки гена антитела. Знайте, что хотя на изображении используются сегменты D и J, такой же тип перестройки происходит и с другими парами сегментов. Под действием ферментов RAG 1/2 расщепленная двухцепочечная ДНК остается структура шпильки на конце каждого сегмента ДНК, созданного событием расщепления. Обе шпильки открываются комплексом Artemis, который при фосфорилировании проявляет эндонуклеазную активность, обеспечивая свободные 3'-концы ОН, на которые действует TdT. После того, как комплекс Artemis выполнил свою работу и добавил палиндромные нуклеотиды (P-нуклеотиды) к недавно открывшимся шпилькам ДНК, TdT приступил к выполнению своей работы. TdT теперь может входить и добавлять N-нуклеотиды к существующим P-нуклеотидам в направлении от 5 'до 3', в котором, как известно, функционируют полимеразы. В среднем 2-5 случайных пар оснований добавляются к каждому 3'-концу, образующемуся после действия комплекса Artemis. Количество добавленных оснований достаточно, чтобы два вновь синтезированных сегмента оцДНК подверглись микрогомологическому выравниванию во время негомологичного соединения концов в соответствии с нормальным спариванием оснований Уотсона-Крика паттерны (AT, CG). Оттуда неспаренные нуклеотиды вырезаются экзонуклеазой, такой как комплекс Artemis (который обладает экзонуклеазной активностью в дополнение к эндонуклеазной активности), а затем матрично-зависимые полимеразы могут заполнить пробелы, в конечном итоге создавая новый кодирующий стык с действием лигазы для объединения сегменты. Хотя TdT не различает четыре пары оснований при добавлении их к N-нуклеотидным сегментам, он показал смещение для пар оснований гуанин и цитозин.
 TDT, связанный с тремя цепями ДНК, демонстрируя активную конфигурацию его зависимого от матрицы катализа.
TDT, связанный с тремя цепями ДНК, демонстрируя активную конфигурацию его зависимого от матрицы катализа. В зависимости от матрицы TdT может включать нуклеотиды через разрывы цепей в двухцепочечной ДНК способом, называемым в транс в отличие от цис-механизма, обнаруженного в большинстве полимераз. Оптимально это происходит при разрыве одной пары оснований между цепями и в меньшей степени при увеличении зазора. Этому способствует часть TdT, называемая Loop1, которая выборочно исследует короткие разрывы в двухцепочечной ДНК. Кроме того, открытие этой зависимой от шаблона активности привело к более убедительным механистическим гипотезам относительно того, как распределение длин добавлений N-участков возникает при рекомбинации V (D) J.
 Графическая диаграмма, изображающая транс-шаблон зависимая активность терминальной дезоксинуклеотидилтрансферазы. Петля 1 выделена красным.
Графическая диаграмма, изображающая транс-шаблон зависимая активность терминальной дезоксинуклеотидилтрансферазы. Петля 1 выделена красным. Полимераза μ и полимераза λ проявляют аналогичную трансформируемую зависимую синтетическую активность с TdT, но без подобной зависимости от расположенной ниже двухцепочечной ДНК. Кроме того, было обнаружено, что полимераза λ проявляет аналогичную независимую от матрицы синтетическую активность. Известно, что наряду с активностью терминальной трансферазы он также работает в более общем виде, зависимом от шаблона. Сходство между TdT и полимеразой μ предполагает, что они тесно эволюционно связаны.
Терминальная трансфераза находит применение в молекулярной биологии. Его можно использовать в RACE для добавления нуклеотидов, которые затем можно использовать в качестве матрицы для праймера в последующей ПЦР. Его также можно использовать для добавления нуклеотидов, меченных радиоактивными изотопами, например, в TUNEL assay (Tэминальная дезоксинуклеотидилтрансфераза d U TP N ick E nd L abeling) для демонстрации апоптоза (который частично отмечен фрагментированной ДНК). Он также используется в иммунофлуоресцентном анализе для диагностики острого лимфобластного лейкоза.
В иммуногистохимии антитела к TdT могут использоваться для демонстрации наличия незрелых Т- и В-клеток и плюрипотентных гемопоэтические стволовые клетки, которые обладают антигеном, тогда как зрелые лимфоидные клетки всегда TdT-отрицательные. В то время как TdT-положительные клетки обнаруживаются в небольшом количестве в здоровых лимфатических узлах и миндалинах, злокачественные клетки острого лимфобластного лейкоза также являются TdT-положительными, и поэтому антитело можно использовать как часть панели для диагностики этого заболевания и отличить его, например, от мелкоклеточных опухолей у детей.
TdT также недавно был применен в синтезе олигонуклеотидов De Novo с привязанными аналогами TdT-dNTP, способными удлинять праймер на 1 нуклеотид за раз. Другими словами, фермент TdT продемонстрировал способность создавать синтетическую ДНК, добавляя по одной букве к последовательности праймера.