| Гематопоэтические стволовые клетки | |
|---|---|
 Обзор нормального гематопоэза человека Обзор нормального гематопоэза человека | |
| Подробности | |
| Система | Кроветворная система |
| Расположение | Костный мозг |
| Функция | Стволовые клетки, дающие начало другим клеткам крови |
| Идентификаторы | |
| Латинские | Cellula haematopoietica praecursoria |
| Акроним (ы) | HSC |
| MeSH | D006412 |
| TH | H2.00.01.0.00006 |
| Анатомические термины микроанатомии. [редактировать на Викиданных ] | |
Гематопоэтические стволовые клетки (HSC ) - это стволовые клетки, которые дают начало другим клеткам крови. Этот процесс называется гематопоэзом. Этот процесс происходит в красном костном мозге, в сердцевине большинства костей. В эмбриональном развитии красный костный мозг происходит из слоя эмбриона, называемого мезодермой.
Гематопоэз - это процесс, посредством которого производятся все зрелые клетки крови. Он должен уравновешивать огромные производственные потребности (средний человек производит более 500 миллиардов клеток крови каждый день) с необходимостью регулировать количество клеток крови каждого типа в кровообращении. У позвоночных подавляющее большинство кроветворения происходит в костном мозге и происходит из ограниченного числа гемопоэтических стволовых клеток, которые являются мультипотентными и способны к обширному самообновлению.
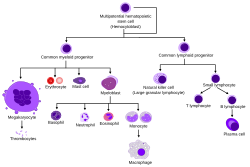
Гематопоэтические стволовые клетки дают начало различным типам клеток крови в линиях, называемых миелоидными и лимфоидными. И миелоидные, и лимфоидные клоны участвуют в образовании дендритных клеток. Миелоидные клетки включают моноциты, макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты и от мегакариоцитов до тромбоцитов. Лимфоидные клетки включают Т-клетки, В-клетки, естественные клетки-киллеры и врожденные лимфоидные клетки. Определение гемопоэтических стволовых клеток развилось с тех пор, как они были впервые обнаружены в 1961 году. Гематопоэтическая ткань содержит клетки с долгосрочными и краткосрочными способностями к регенерации и коммитированные мультипотентные, олигопотентные и унипотентные прародители. Гемопоэтические стволовые клетки составляют 1: 10 000 клеток в миелоидной ткани.
Трансплантаты HSC используются для лечения рака и других нарушений иммунной системы.
Они круглый, неприлипающий, с округлым ядром и низким соотношением цитоплазмы к ядру. По форме гемопоэтические стволовые клетки напоминают лимфоциты.
Гематопоэтические стволовые клетки обнаруживаются в костном мозге взрослых, особенно в тазу, бедренная кость и грудина. Они также обнаруживаются в пуповинной крови и, в небольших количествах, в периферической крови.
Стволовые клетки и клетки-предшественники могут быть взяты из таза, на гребне подвздошной кости, с помощью иглы и шприца.. Клетки могут быть удалены в жидком виде (для получения мазка для изучения морфологии клеток) или их можно удалить с помощью центральной биопсии (для сохранения архитектуры или взаимосвязи клеток друг с другом и с костью).
Колониеобразующая единица - это подтип HSC. (Это значение термина отличается от колониеобразующих единиц микробов, которые являются единицей подсчета клеток.) Существуют различные виды колоний HSC: образующие единицы:
Вышеуказанные КОЕ основаны на Другая КОЕ, колониеобразующая единица - селезенка (КОЕ-С), была основой клонального образования колоний in vivo, которое зависит от способности инфузированных клеток костного мозга давать начало клонам созревающих гемопоэтических клеток в селезенки облученных мышей через 8–12 дней. Он широко использовался в e это исследование, но теперь считается, что для измерения более зрелых клеток-предшественников или транзитных амплифицирующих клеток, а не стволовых клеток.
Поскольку гемопоэтические стволовые клетки не могут быть выделены как чистая популяция, их невозможно идентифицировать под микроскопом. Гемопоэтические стволовые клетки могут быть идентифицированы или выделены с помощью проточной цитометрии, где комбинация нескольких различных маркеров клеточной поверхности (в частности, CD34 ) используется для отделения редких гемопоэтических стволовых клеток от окружающие клетки крови. Гематопоэтические стволовые клетки не экспрессируют маркеры зрелых клеток крови и поэтому называются Lin-. Отсутствие экспрессии маркеров клонов используется в сочетании с обнаружением нескольких положительных маркеров клеточной поверхности для выделения гемопоэтических стволовых клеток. Кроме того, гемопоэтические стволовые клетки характеризуются небольшим размером и низким уровнем окрашивания жизненно важными красителями, такими как родамин 123 (родамин) или Hoechst 33342 (побочная популяция).
 Схема клеток, которые возникают из гематопоэтических стволовых клеток в процессе гематопоэза.
Схема клеток, которые возникают из гематопоэтических стволовых клеток в процессе гематопоэза.Гематопоэтические стволовые клетки необходимы для гематопоэза, образования клеток в крови. Гемопоэтические стволовые клетки могут восполнять все типы клеток крови (т. Е. мультипотентны ) и самообновляться. Небольшое количество гемопоэтических стволовых клеток может увеличиваться с образованием очень большого количества дочерних гемопоэтических стволовых клеток. Этот феномен используется при трансплантации костного мозга, когда небольшое количество гемопоэтических стволовых клеток восстанавливает кроветворную систему. Этот процесс указывает на то, что после трансплантации костного мозга должно произойти симметричное деление клеток на две дочерние гемопоэтические стволовые клетки.
Считается, что самообновление стволовых клеток происходит в нише стволовых клеток в костном мозге, и разумно предположить, что ключевые сигналы, присутствующие в этой нише, будут важны для самообновления. обновление. Большой интерес вызывают экологические и молекулярные требования к самообновлению HSC, поскольку понимание способности HSC к самовосстановлению в конечном итоге позволит генерировать увеличенные популяции HSC in vitro, которые можно использовать в терапевтических целях.
Гематопоэтические стволовые клетки, как и все взрослые стволовые клетки, в основном находятся в состоянии покоя или в состоянии обратимой остановки роста. Измененный метаболизм покоящихся HCS помогает клеткам выживать в течение продолжительных периодов времени в гипоксической среде костного мозга. Спровоцированные гибелью или повреждением клеток, гемопоэтические стволовые клетки выходят из состояния покоя и снова начинают активно делиться. Переход от покоя к размножению и обратно регулируется путем пути MEK / ERK и пути PI3K / AKT / mTOR. Нарушение регуляции этих переходов может привести к истощению стволовых клеток или постепенной потере активных гемопоэтических стволовых клеток в системе крови.
Гематопоэтические стволовые клетки обладают более высоким потенциалом, чем другие незрелые клетки крови преодолевать барьер костного мозга и, таким образом, может перемещаться с кровью из костного мозга в одной кости в другую кость. Если они оседают в тимусе, они могут развиться в Т-клетки. В случае плода и другого экстрамедуллярного кроветворения гемопоэтические стволовые клетки могут также оседать и развиваться в печени или селезенке.
Это позволяет собирать гемопоэтические стволовые клетки непосредственно из крови.
Разрывы цепи ДНК накапливаются в долгосрочных гемопоэтических стволовых клетках во время старения. Это накопление связано с широким ослаблением путей репарации ДНК и ответа, которые зависят от покоя HSC. Негомологичное соединение концов (NHEJ) - это путь, который восстанавливает двухцепочечные разрывы в ДНК. NHEJ называют «негомологичным», потому что концы разрыва непосредственно лигируются без необходимости в гомологичной матрице. Путь NHEJ зависит от нескольких белков, включая лигазу 4, ДНК-полимеразу mu и фактор 1 NHEJ (NHEJ1, также известный как Cernunnos или XLF).
ДНК-лигаза 4 (Lig4) играет высокоспецифичную роль в репарации двухцепочечных разрывов с помощью NHEJ. Дефицит Lig4 у мышей вызывает прогрессирующую потерю гемопоэтических стволовых клеток во время старения. Дефицит lig4 в плюрипотентных стволовых клетках приводит к накоплению двухцепочечных разрывов ДНК и усилению апоптоза.
У мышей, мутантных по полимеразе mu, развитие гемопоэтических клеток нарушено в нескольких популяциях периферических клеток и клеток костного мозга с примерно 40% уменьшение количества клеток костного мозга, которое включает несколько гемопоэтических ветвей. Потенциал роста гемопоэтических клеток-предшественников также снижается. Эти характеристики коррелируют со сниженной способностью восстанавливать двухцепочечные разрывы в кроветворной ткани.
Дефицит фактора 1 NHEJ у мышей приводит к преждевременному старению гемопоэтических стволовых клеток, на что указывают несколько линий доказательств, включая доказательства того, что долгосрочное репопуляция является дефектной и ухудшается с течением времени. Используя индуцированную человеком модель дефицита NHEJ1 плюрипотентными стволовыми клетками, было показано, что NHEJ1 играет важную роль в обеспечении выживания примитивных гематопоэтических предшественников. Эти клетки с дефицитом NHEJ1 обладают слабой способностью к репарации, опосредованной NHEJ1, которая, очевидно, неспособна справиться с повреждениями ДНК, вызванными физиологическим стрессом, нормальным метаболизмом и ионизирующим излучением.
Чувствительность гемопоэтических стволовых клеток к Lig4, ДНК-полимеразе Дефицит mu и NHEJ1 предполагает, что NHEJ является ключевым фактором, определяющим способность стволовых клеток противостоять физиологическому стрессу с течением времени. Росси и др. обнаружили, что эндогенные повреждения ДНК накапливаются с возрастом даже в гемопоэтических стволовых клетках дикого типа, и предположили, что накопление повреждений ДНК может быть важным физиологическим механизмом старения стволовых клеток.
Трансплантация гемопоэтических стволовых клеток (HSCT) - это трансплантация мультипотентных гемопоэтических стволовых клеток, обычно происходящих из периферического костного мозга кровь или пуповинная кровь. Он может быть аутологичным (используются собственные стволовые клетки пациента), аллогенным (стволовые клетки поступают от донора) или сингенным (от однояйцевого близнеца).
Чаще всего его проводят у пациентов с некоторыми раками крови или костного мозга, такими как множественная миелома или лейкоз. В этих случаях иммунная система реципиента обычно разрушается лучевой или химиотерапией перед трансплантацией. Инфекция и реакция трансплантат против хозяина являются основными осложнениями аллогенного ТГСК.
Для сбора стволовых клеток из циркулирующей периферической крови донорам крови вводят цитокин, такой как фактор, стимулирующий колонии гранулоцитов (G-CSF), который побуждает клетки покидать костный мозг и циркулировать в кровеносных сосудах. В эмбриологии млекопитающих первые дефинитивные гемопоэтические стволовые клетки обнаруживаются в AGM (aorta-gonad-mesonephros ), а затем массово размножаются в печени плода до колонизации костного мозга до рождения.
Трансплантация гемопоэтических стволовых клеток остается опасной процедурой со многими возможными осложнениями; он предназначен для пациентов с опасными для жизни заболеваниями. Поскольку выживаемость после процедуры увеличилась, его использование расширилось за пределы рака до аутоиммунных заболеваний и наследственных дисплазий скелета ; особенно злокачественный детский остеопетроз и мукополисахаридоз.
Клетка, образующая площадь из булыжника (CAFC) анализ представляет собой эмпирический анализ на основе клеточных культур. При посеве на конфлюэнтную культуру стромы часть гемопоэтических стволовых клеток проникает между промежутками (даже если стромальные клетки соприкасаются друг с другом) и в конечном итоге оседает между стромальными клетками и субстратом (здесь поверхность чашки) или застревает в ней. клеточные отростки между стромальными клетками. Эмпериполез - это явление in vivo, при котором одна клетка полностью поглощается другой (например, тимоциты в питательные клетки тимуса ); с другой стороны, когда in vitro лимфоидные клетки подползают под ним, этот процесс называется. Это похожее явление более широко известно в области HSC по терминологии клеточных культур: клетки, образующие площадь из булыжника (CAFC), что означает, что области или кластеры клеток выглядят тусклыми булыжником под фазово-контрастной микроскопией по сравнению с к другим гемопоэтическим стволовым клеткам, которые рефрактильны. Это происходит потому, что клетки, которые свободно плавают поверх стромальных клеток, имеют сферическую форму и, следовательно, преломляют. Однако клетки, которые проникают под стромальные клетки, уплощены и, следовательно, не преломлены. Механизм псевдоэмпериполеза стал известен совсем недавно. Это может быть опосредовано взаимодействием через CXCR4 (CD184) рецептор для хемокинов CXC (например, SDF1 ) и α4β1 интегринов.
Гематопоэтические стволовые клетки (HSC) нелегко наблюдать напрямую, и, следовательно, их поведение необходимо делать косвенно. Клональные исследования, вероятно, являются наиболее близким методом к изучению одноклеточных in vivo HSC. Здесь используются сложные экспериментальные и статистические методы, чтобы убедиться, что с высокой вероятностью один HSC содержится в трансплантате, введенном смертельно облученному хозяину. Затем можно наблюдать клональную экспансию этой стволовой клетки с течением времени, отслеживая процент клеток донорского типа в крови по мере восстановления хозяина. Результирующий временной ряд определяется как кинетика репопуляции HSC.
Кинетика восстановления очень неоднородна. Однако, используя символическую динамику, можно показать, что они попадают в ограниченное количество классов. Чтобы доказать это, несколько сотен экспериментальных кинетик репопуляции из клональных Thy-1 SCA-1 lin c-kit HSC были переведены в символические последовательности путем присвоения символов «+», «-», «~» при двух последовательных измерениях процента донора. Ячейки -типа имеют положительный, отрицательный или неизменный наклон соответственно. Используя расстояние Хэмминга, образцы репопуляции подвергали кластерному анализу, в результате чего были получены 16 различных групп кинетики. Чтобы завершить эмпирическое доказательство, было использовано для определения того, что вероятность обнаружения кинетики, не содержащейся в этих 16 группах, очень мала. Как следствие, этот результат показывает, что компартмент гематопоэтических стволовых клеток также неоднороден по динамическим критериям.
Первоначально считалось, что все гемопоэтические стволовые клетки одинаковы по своей способности к самообновлению и дифференцировке. Впервые эта точка зрения была оспорена открытием 2002 года группой Мюллера-Зибурга из Сан-Диего, которая проиллюстрировала, что разные стволовые клетки могут демонстрировать различные паттерны репопуляции, которые являются эпигенетически предопределенными внутренними свойствами клонального Thy-1 Sca-1. lin c-kit HSC. Результаты этих клональных исследований привели к понятию систематической ошибки происхождения . Используя соотношение 
Впоследствии другие группы подтвердили и подчеркнули исходные данные. Напр., Группа Eaves подтвердила в 2007 году, что кинетика репопуляции, долговременная способность к самообновлению и My-bi и Ly-bi являются стабильно унаследованными внутренними свойствами HSC. В 2010 году группа Goodell предоставила дополнительную информацию о молекулярных основах смещения клонов в HSC боковой популяции (SP) SCA-1 lin c-kit. Как ранее было показано для передачи сигналов IL-7, было обнаружено, что член семейства трансформирующего фактора роста (TGF-бета) индуцирует и ингибирует пролиферацию HSC My-bi и Ly-bi, соответственно.
От греческого haimato-, сочетающего форму haima «кровь», и от латинизированной формы греческого poietikos «способный творить, производить», от poiein «делать, create ".