 | |
| Имена | |
|---|---|
| Имя ИЮПАК S- [2- [3 - [[4 - [[[(2R, 3S, 4R, 5R) -5- (6-аминопурин-9-ил) -4-гидрокси-3-фосфонооксиоксолан-2-ил] метоксигидроксифосфорил] окси-гидроксифосфорил] окси-2- гидрокси-3,3-диметилбутаноил] амино] пропаноиламино] этил] пропантиоат | |
| Другие названия пропионил-кофермент А; Пропаноил-коэнзим A | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.005.698 |
| MeSH | пропионил-коэнзим + A |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | C24H40N7O17P3S |
| Молярная масса | 823,60 г / моль |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на ink | |
Пропионил-КоА представляет собой производное кофермента A пропионовой кислоты. Он состоит из 24 углеродных цепей (без кофермента, это трехуглеродная структура), и его производство и метаболическая судьба зависят от того, в каком организме он присутствует. Несколько различных путей могут привести к его производству, например, через катаболизм. конкретных аминокислот или окисления жирных кислот с нечетной цепью. Позже он может быть расщеплен пропионил-КоА-карбоксилазой или через цикл метилцитрата. Однако у разных организмов пропионил-КоА может быть изолирован в контролируемых областях, чтобы уменьшить его потенциальную токсичность за счет накопления. Генетические недостатки в отношении продукции и распада пропионил-КоА также имеют большое клиническое и человеческое значение.
Существует несколько различных путей, по которым пропионил-КоА может производиться:
 Нечетная цепь Окисление жирных кислот с образованием пропионил-КоА и последующий метаболизм пропионил-КоА-карбоксилазой
Нечетная цепь Окисление жирных кислот с образованием пропионил-КоА и последующий метаболизм пропионил-КоА-карбоксилазой метаболическая (катаболическая судьба) пропионил-КоА зависит от того, в какой среде он синтезируется. Следовательно, пропионил- КоА в анаэробной среде может иметь иную судьбу, чем в аэробном организме. Множественные пути, будь то катаболизм пропионил-КоА-карбоксилазой или метилцитрат-синтазой, также зависят от присутствия различных генов.
В цикле лимонной кислоты у человека, пропионил-КоА, который взаимодействует с оксалоацетатом с образованием метилцитрата, также может катализироваться в метилмалонил-КоА посредством карбоксилирования с помощью пропионил-КоА-карбоксилазы (PCC). Метилмалонил-КоА позже превращается в сукцинил-КоА для дальнейшего использования в цикле трикарбоновой кислоты. PCC не только катализирует карбоксилирование пропионил-КоА до метилмалонил-КоА, но также действует на несколько различных ацил-КоА. Тем не менее, его наибольшее сродство связывания имеет пропионил-КоА. Кроме того, было показано, что трансформация пропионил-КоА ингибируется отсутствием нескольких маркеров ТСА, таких как глутамат. Механизм показан на рисунке слева.
У млекопитающих пропионил-КоА превращается в (S) - метилмалонил-КоА посредством пропионил-КоА-карбоксилаза, биотин -зависимый фермент, также требующий бикарбоната и АТФ.
. Этот продукт превращается в (R) -метилмалонил-КоА метилмалонил-КоА рацемазой.
(R) -метилмалонил-КоА превращается в сукцинил-КоА, промежуточное соединение в цикле трикарбоновых кислот, с помощью мутазы метилмалонил-КоА, фермент, требующий
 химерной структуры пропионил-CoA-карбоксилазы
химерной структуры пропионил-CoA-карбоксилазы кобаламина для катализа миграции углерод-углеродной связи.
Механизм метилмалонил-КоА мутазы начинается с расщепления связи между 5'СН. 2- 5'-дезоксиаденозила и кобальтом, который окисляется 3+. состояние (III), которое дает 5'- дезоксиаденозильный радикал и кобаламин в восстановленном состоянии окисления Со (II).
Затем этот радикал отрывает атом водорода от метильной группы метилмалонил-КоА, что приводит к образованию радикала метилмалонил-КоА. Считается, что этот радикал образует углерод-кобальтовую связь с коферментом, за которой затем следует перегруппировка углеродного скелета субстрата, в результате чего образуется радикал сукцинил-КоА. Этот радикал затем продолжает отщеплять водород от ранее полученного 5'-дезоксиаденозина, снова создавая дезоксиаденозильный радикал, который атакует кофермент для преобразования исходного комплекса.
Дефект фермента метилмалонил-КоА мутазы приводит к метилмалоновой ацидурии, опасному заболеванию, которое вызывает снижение pH крови.
 Путь цикла метилцитрата, демонстрирующий превращение пропионата в пропионил -CoA к различным промежуточным соединениям в цикле метилцитрата, высвобождая 4 чистых водорода. (Ферменты в кружках, промежуточные продукты в квадратах)
Путь цикла метилцитрата, демонстрирующий превращение пропионата в пропионил -CoA к различным промежуточным соединениям в цикле метилцитрата, высвобождая 4 чистых водорода. (Ферменты в кружках, промежуточные продукты в квадратах) Накопление пропионил-КоА может оказаться токсичным для различных организмов. Поскольку были предложены различные циклы в отношении того, как пропионил-КоА превращается в пируват, одним из изученных механизмов является: Начальная реакция - это бета-окисление с образованием пропионил-КоА, который далее расщепляется циклом. В этом пути участвуют ферменты, связанные как с циклом метилцитрата, так и с циклом лимонной кислоты. Все это способствует общей реакции по детоксикации бактерий от вредного пропионил-КоА. Это также считается конечным путем из-за катаболизма жирных кислот микобактерий. Чтобы продолжить, ген prpC кодирует метилцитрат-синтазу, и, если он не присутствует, цикл метилцитрата не произойдет. Вместо этого катаболизм происходит через пропионил-КоА карбоксилазу. Этот механизм показан ниже слева вместе с участвующими реагентами, продуктами, промежуточными продуктами и ферментами.
На окисление пропионил-КоА с образованием пирувата влияет его необходимость в Mycobacterium tuberculosis. Накопление пропионил-КоА может привести к токсическим эффектам. Было высказано предположение, что в случае Mycobacterium tuberculosis метаболизм пропионил-КоА участвует в биогенезе клеточной стенки . Отсутствие такого катаболизма, следовательно, увеличило бы восприимчивость клетки к различным токсинам, особенно к макрофагам антимикробным механизмам. Другая гипотеза относительно судьбы пропионил-КоА в M. tuberculosis заключается в том, что, поскольку пропионил-КоА продуцируется катаболизмом бета-нечетноцепочечных жирных кислот, цикл метилцитрата впоследствии активируется, чтобы свести на нет любую потенциальную токсичность, действуя как буферный механизм. 115>
Пропионил-КоА может оказывать множество неблагоприятных и токсических воздействий на разные виды, включая бактерии. Например, ингибирование пируватдегидрогеназы накоплением пропионил-КоА в Rhodobacter sphaeroides может оказаться смертельным. Кроме того, как и в случае с Э. coli, приток пропионил-КоА у видов Myobacterial может привести к токсичности, если с ним не бороться немедленно. Эта токсичность вызывается путем вовлечения липидов, которые образуют бактериальную клеточную стенку. Используя этерификацию длинноцепочечных жирных кислот, избыток пропионил-КоА может быть изолирован и сохранен в липиде, триацилглицерине (ТАГ), что приводит к регуляции повышенных уровней пропионил-КоА. Такой процесс метильного разветвления жирных кислот заставляет их действовать как поглотители для накопления пропиона
В исследовании, проведенном Луо и др., Escherichia coli штаммов были использованы для изучения того, как метаболизм пропионил-КоА может потенциально приводить к продукции 3-гидроксипропионовой кислоты (3-HP). Было показано, что мутация в ключевом гене, участвующем в этом пути, приводит к значительному увеличению 3-HP. Однако это все еще развивающаяся область, и информация по этой теме ограничена.
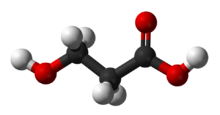 Структура 3-гидроксипропионовой кислоты, продукта бактериального метаболизма в E. coli.
Структура 3-гидроксипропионовой кислоты, продукта бактериального метаболизма в E. coli. Метаболизм аминокислот в растениях было признано спорным вопросом, из-за отсутствия конкретных доказательств для любого конкретного пути. Однако было высказано предположение, что участвуют ферменты, связанные с производством и использованием пропионил-КоА. С этим связан метаболизм изобутирил-КоА. Эти две молекулы считаются промежуточными продуктами метаболизма валина. Поскольку пропионат представляет собой пропионил-КоА, было обнаружено, что пропионил-КоА превращается в ферментативный путь пероксисомального β-окисления. Тем не менее у растения Arabidopsis ключевые ферменты превращения валина в пропионил-КоА не наблюдались. В ходе различных экспериментов, проведенных Lucas et al., Было высказано предположение, что у растений через пероксисомальные ферменты пропионил-КоА (и изобутирил-КоА ) участвуют в метаболизме многих различные субстраты (в настоящее время оцениваются на идентичность), а не только валин.
 Aspergillus nidulans в среде для грибов. Эти грибы были использованы для анализа метаболизма пропионил-КоА и синтеза поликетидов.
Aspergillus nidulans в среде для грибов. Эти грибы были использованы для анализа метаболизма пропионил-КоА и синтеза поликетидов. Производство пропионил-КоА посредством катаболизма жирных кислот также связано с. В исследовании, касающемся Aspergillus nidulans, было обнаружено, что при ингибировании гена метилцитрат синтазы, mcsA, пути, описанного выше, продуцируются отдельные поликетиды тоже было подавлено. Таким образом, использование пропионил-КоА через цикл метилцитрата снижает его концентрацию, а затем увеличивает концентрацию поликетидов. Поликетид отличается от более широко известного соединения, полипептида, тем, что поликетид представляет собой структуру, обычно обнаруживаемую в грибах, которая состоит из ацетила - и малонила -CoAs. Они обладают определенными свойствами, которые расширили исследования их лечебных и потенциально вредных свойств за счет ограничения токсичности поликетидов для сельскохозяйственных культур в сельском хозяйстве за счет фитопатогенных грибов.
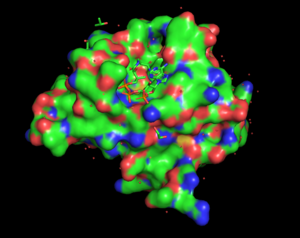 пропиоил-КоА взаимодействует с активным каталитическим сайтом Gen5. Gen5 показан с использованием шариков модели, заполняющей пространство, в то время как пропионил-КоА показан в виде палочки, обнаруженной в середине комплекса.
пропиоил-КоА взаимодействует с активным каталитическим сайтом Gen5. Gen5 показан с использованием шариков модели, заполняющей пространство, в то время как пропионил-КоА показан в виде палочки, обнаруженной в середине комплекса. Подобно тому, как пероксисомальные ферменты растений связывают пропионил-КоА и изобутирил -CoA, Gen5, ацетилтрансфераза у человека, связывается с пропионил-КоА и бутирил-КоА. Они специфически связываются с каталитическим доменом Gen5L2. Эта консервативная ацетилтрансфераза отвечает за регуляцию транскрипции посредством лизина ацетилирования гистона N-концевых хвостов. Эта функция ацетилирования имеет гораздо более высокую скорость реакции, чем или. Благодаря структуре пропионил-КоА, Gen5 различает различные молекулы ацил-КоА. Фактически, было обнаружено, что пропильная группа бутирл-КоА не может связываться из-за отсутствия стереоспецифичности с активным сайтом связывания Gen5 из-за ненасыщенных ацильных цепей. С другой стороны, третий атом углерода пропионил-КоА может соответствовать активному сайту Gen5 с правильной ориентацией.
В неонатальные стадии развития, пропионовая ацидемия, которая представляет собой медицинскую проблему, определяемую как недостаток пропионил-КоА-карбоксилазы, может вызывать нарушения, умственную отсталость и многие другие проблемы. Это вызвано накоплением пропионил-КоА, поскольку он не может быть преобразован в метилмалонил-КоА. Новорожденные проходят обследование на повышенное. Дальнейшие способы диагностики этого заболевания включают анализ мочи. Используемые лекарства помогают обратить вспять и предотвратить повторяющиеся симптомы, включая использование добавок для снижения выработки пропионата.