Участие в соседней группе (NGP ) (также известное как анхимерная помощь ) в органической химии было определено IUPAC как взаимодействие реакционного центра с неподеленной парой электронов в атоме или электронами, присутствующими в атоме. сигма-связь или пи-связь, содержащиеся в исходной молекуле, но не конъюгированные с реакционным центром. Когда NGP работает, скорость реакции увеличивается - это нормально. Также возможно, что стереохимия реакции будет аномальной (или неожиданной) по сравнению с нормальной реакцией. Хотя соседние группы могут влиять на многие реакции в органической химии (например, реакция диена, такого как 1,3-циклогексадиен, с малеиновым ангидридом, обычно дает эндо изомер из-за вторичного эффекта (перекрытие π-орбиталей карбонильной группы с переходным состоянием в реакции Дильса-Альдера }) эта страница ограничена эффектами соседней группы, наблюдаемыми с карбокатионами и S N 2 реакции.
Классическим примером NGP является реакция серы или азотный иприт с нуклеофилом, скорость реакции для серного иприта и нуклеофила намного выше, чем для первичного алкил хлорида без гетероатома.

Ph-S-CH 2 -CH 2 -Cl реагирует с водой в 600 раз быстрее, чем CH 3 -CH 2 -CH 2 -Cl
π-орбитали алкена могут стабилизировать переходное состояние, помогая делокализовать положительный заряд карбокатиона. Например, ненасыщенный тозилат будет реагировать быстрее (в 10 раз быстрее для водного сольволиза) с нуклеофилом, чем насыщенный тозилат.
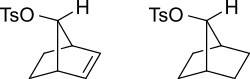
Карбокатионный промежуточный продукт будет стабилизирован посредством резонанса, при котором положительный заряд распространяется на несколько атомов. На схеме ниже это показано.
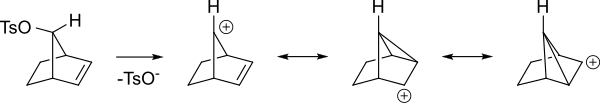
Вот другой взгляд на те же промежуточные продукты.

Даже если алкен находится дальше от реакционного центра, алкен все равно может действовать таким образом. Например, в следующем алкил бензолсульфонате алкен способен делокализовать карбокатион.
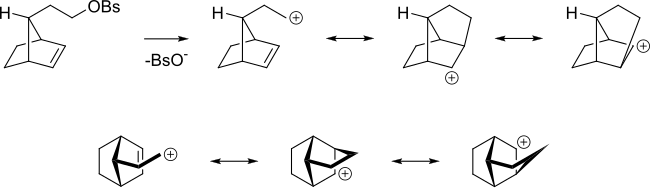
Также увеличение скорости реакции SN2 аллил бромида с нуклеофилом по сравнению с реакцией н-пропилбромида обусловлено тем, что орбитали связи π перекрываются со связями переходного состояния . В аллильной системе алкеновые орбитали перекрываются с орбиталями переходного состояния S N 2.
Если циклопропилметилхлорид взаимодействует с этанолом и водой, тогда смесь 48% циклопропилметил спирт, 47% циклобутанол и 5% спирт (бут-3-енол). Это связано с тем, что карбокатионный промежуточный продукт делокализован на многих различных атомах углерода через обратимое отверстие в кольце.

В случае бензил галогенида реакционная способность выше, потому что переходное состояние S N 2 обладает аналогичным эффектом перекрытия, что и что в аллильной системе.

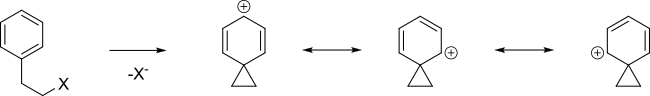
ароматическое кольцо может способствовать образованию карбокатионного промежуточного соединения, называемого ионом фенония, путем делокализации положительного заряда.
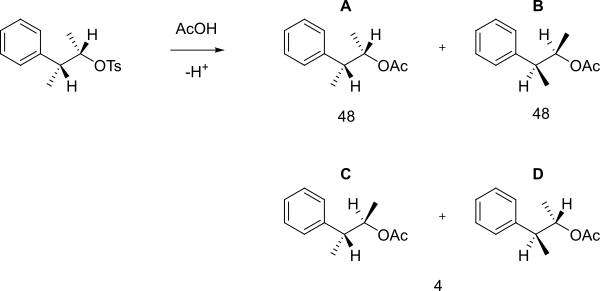
Когда следующий тозилат реагирует с уксусной кислотой в сольволизе, а не в простой реакции SN2 с образованием B, a 48: Была получена смесь 48: 4 A, B (которые являются энантиомерами) и C + D.
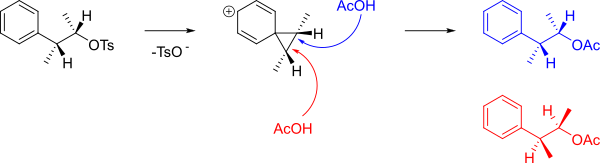
Механизм, образующий A и B, показан ниже.
..
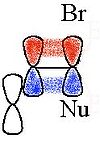
Алифатические связи C-C или C-H могут приводить к делокализации заряда, если эти связи являются близкими и антиперипланарными по отношению к уходящей группе. Соответствующие промежуточные соединения относятся к неклассическим ионам, причем система 2-норборнил является наиболее известным случаем.