Посттранскрипционная регуляция - это контроль экспрессии гена на уровне РНК, следовательно, между транскрипцией и трансляцией гена . Он вносит существенный вклад в регуляцию экспрессии генов в тканях человека.
После получения стабильность и распределение различных транскриптов регулируется (посттранскрипционная регуляция) средства РНК связывания белка (RBP), которые контролируют различные этапы и скорости контролирующих событий, таких как альтернативный сплайсинг, ядерная деградация (экзосома ), обработка, ядерный экспорт (три альтернативных пути), секвестрация в P-тельцах для хранения или разложения и, в конечном итоге, трансляция. Эти белки достигают этих результатов благодаря мотиву распознавания РНК (RRM), который связывает определенную последовательность или вторичную структуру транскриптов, обычно в 5 ' и 3' UTR. стенограммы. Короче говоря, последовательности дцРНК, которые будут разбиты на миРНК внутри организма, будут совпадать с РНК, чтобы ингибировать экспрессию гена в клетке.
Модуляция кэппинга, сплайсинга, добавления Poly (A) -хвоста, специфичных для последовательности скоростей ядерного экспорта и в некоторых контекстах секвестрация РНК-транскрипта происходит у эукариот, но не у прокариот. Эта модуляция является результатом белка или транскрипта, который, в свою очередь, регулируется и может иметь сродство к определенным последовательностям.
МикроРНК (миРНК), по-видимому, регулируют экспрессию более 60% генов, кодирующих белок человека геном. Если миРНК в изобилии, она может действовать как «переключатель», включая или выключая некоторые гены. Однако измененная экспрессия многих miRNAs приводит только к умеренным 1,5-4-кратным изменениям экспрессии белков их генов-мишеней. Отдельные miRNA часто репрессируют несколько сотен генов-мишеней. Репрессия обычно происходит либо за счет подавления трансляции мРНК, либо за счет деградации мРНК через комплементарное связывание, в основном со специфическими последовательностями в 3'-нетранслируемой области мРНК целевого гена. Механизм трансляционного сайленсинга или деградации мРНК реализуется посредством РНК-индуцированного комплекса сайленсинга (RISC).
У многоклеточных животных и бактерий многие гены, участвующие в пост-пост-транскрипционной регуляции, регулируются посттранскрипционно. Для RBP у дрозофилы, связанных со сплайсингом или нонсенс-опосредованным распадом, анализ профилей взаимодействия белок-белок и белок-РНК выявил повсеместные взаимодействия с РНК и белковыми продуктами одного и того же гена. Остается неясным, вызваны ли эти наблюдения проксимальными или опосредованными рибосомами контактами, или если некоторые белковые комплексы, особенно RNPs, подвергаются совместной трансляционной сборке.
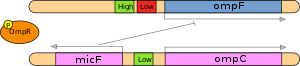 Пример прокариот: Salmonella enterica (патогенная γ-протеобактерия) может экспрессировать два альтернативных порина в зависимости от внешней среды (кишечник или мутная вода), эта система включает EnvZ (осомотический датчик), который активирует OmpR (фактор транскрипции), который может связываться с промотором с высоким сродством даже при низких концентрациях, а с промотором с низким сродством только при высоких концентрациях (по определению): когда концентрация этого фактора транскрипции высока, он активирует OmpC и micF и ингибирует OmpF, OmpF. дополнительно ингибируется посттранскрипционно РНК micF, которая связывается с транскриптом OmpF
Пример прокариот: Salmonella enterica (патогенная γ-протеобактерия) может экспрессировать два альтернативных порина в зависимости от внешней среды (кишечник или мутная вода), эта система включает EnvZ (осомотический датчик), который активирует OmpR (фактор транскрипции), который может связываться с промотором с высоким сродством даже при низких концентрациях, а с промотором с низким сродством только при высоких концентрациях (по определению): когда концентрация этого фактора транскрипции высока, он активирует OmpC и micF и ингибирует OmpF, OmpF. дополнительно ингибируется посттранскрипционно РНК micF, которая связывается с транскриптом OmpF . Эта область исследования в последнее время приобрела большее значение из-за растущих доказательств того, что посттранскрипционная регуляция играет большую роль, чем ожидалось ранее. Хотя белок с ДНК-связывающими доменами более распространен, чем белок с РНК-связывающими доменами, недавнее исследование Cheadle et al. (2005) показали, что во время активации Т-клеток 55% значимых изменений на стационарном уровне не имели соответствующих изменений на уровне транскрипции, что означает, что они были результатом только регуляции стабильности.
Кроме того, обнаружена РНК. в ядре является более сложным, чем в цитоплазме: более 95% (оснований) РНК, синтезируемой РНК-полимеразой II, никогда не достигает цитоплазмы. Основная причина этого заключается в удалении интронов, которые составляют 80% от общего количества оснований. Некоторые исследования показали, что даже после обработки уровни мРНК между цитоплазмой и ядром сильно различаются.
Биология развития - хороший источник моделей регуляции, но из-за технических трудностей было легче определить фактор транскрипции каскадов, чем регуляция на уровне РНК. На самом деле известно, что несколько ключевых генов, таких как нано, связывают РНК, но часто их мишени неизвестны. Хотя РНК-связывающие белки могут регулировать посттранскрипционно большое количество транскриптома, нацеливание одного гена представляет интерес для научного сообщества по медицинским причинам, это РНК-интерференция и микроРНК, которые оба являются примерами посттранскрипционной регуляции, которые регулируют разрушение РНК и изменяют структуру хроматина. Для изучения посттранскрипционной регуляции используется несколько методов, таких как RIP-Chip (РНК иммунопреципитация на чипе).
Дефицит экспрессии гена репарации ДНК встречается при многих раковых заболеваниях (см. дефект репарации ДНК и риск рака и микроРНК и репарация ДНК ). Измененная экспрессия микроРНК (miRNA), которая либо снижает точную репарацию ДНК, либо увеличивает неточную репарацию ДНК, опосредованную микрогомологией, (MMEJ), часто наблюдается при раке. Недостаток точной репарации ДНК может быть основным источником высокой частоты мутаций при раке (см. частоты мутаций при раке ). Репрессия генов репарации ДНК при раке путем изменения уровней микроРНК может быть более частой причиной репрессии, чем мутации или эпигенетическое метилирование генов репарации ДНК.
Например, BRCA1 используется в точном пути гомологичной рекомбинационной репарации (HR). Дефицит BRCA1 может вызвать рак груди. Подавление BRCA1 из-за мутации происходит примерно в 3% случаев рака груди. Подавление BRCA1 из-за метилирования его промотора происходит примерно в 14% случаев рака груди. Однако повышенная экспрессия miR-182 подавляет экспрессию мРНК BRCA1 и белка, а повышенная miR-182 обнаруживается в 80% случаев рака груди.
В другом примере мутировавший конститутивно (постоянно) экспрессируемая версия онкогена c-Myc обнаруживается при многих раковых заболеваниях. Среди многих функций c-Myc отрицательно регулирует микроРНК miR-150 и miR-22. Эти микроРНК обычно подавляют экспрессию двух генов, необходимых для MMEJ, Lig3 и Parp1, тем самым ингибируя этот неточный, мутагенный путь репарации ДНК. Муварак и др. показали при лейкозах, что конститутивная экспрессия c-Myc, приводящая к подавлению miR-150 и miR-22, позволяет повысить экспрессию Lig3 и Parp1. Это вызывает геномную нестабильность из-за увеличения неточной репарации ДНК MMEJ и, вероятно, способствует прогрессированию лейкемии.
Чтобы показать частую способность микроРНК изменять экспрессию репарации ДНК, Hatano et al. выполнили большое скрининговое исследование, в котором 810 микроРНК были трансфицированы в клетки, которые затем подвергались ионизирующему излучению (ИК). Для 324 из этих микроРНК репарация ДНК была снижена (клетки были убиты более эффективно с помощью IR) после трансфекции. Для еще 75 микроРНК репарация ДНК была увеличена с меньшей гибелью клеток после IR. Это указывает на то, что изменения в микроРНК могут часто подавлять репарацию ДНК, что, вероятно, является важным ранним шагом на пути к развитию рака.