A генный драйв - это технология генной инженерии, которая распространяет определенный набор генов в популяции посредством изменение вероятности того, что конкретный аллель будет передан потомству, с естественной 50% вероятности. Генные побуждения могут возникать через множество механизмов. Было предложено обеспечить эффективное средство генетической модификации определенных популяций и целых видов.
В методе можно использовать добавление, удаление, разрушение или изменение генов.
Предлагаемые применения включают уничтожение насекомых-переносчиков патогенов (в частности, комаров, переносящих малярию, денге и возбудителей вируса зика ), борьба с инвазивными видами или устранение устойчивости к гербицидам или пестицидам.
Как и с любым потенциально мощным методом, генные двигатели могут использоваться различными способами или вызывать непредвиденные последствия. Например, генный драйв, предназначенный для воздействия только на местное население, может распространиться на весь вид. Генные драйвы, используемые для искоренения популяций инвазивных видов в их чужеродных средах обитания, могут иметь последствия для популяции вида в целом, даже в его естественной среде обитания. Любое случайное возвращение особей вида в его первоначальные места обитания в результате естественной миграции, нарушения окружающей среды (штормы, наводнения и т. Д.), Случайной перевозки людей или целенаправленного перемещения может непреднамеренно привести к исчезновению вида, если перемещенные особи несут вредный ген. Двигатели.
Генные двигатели могут быть созданы из многих естественных эгоистичных генетических элементов, которые используют различные молекулярные механизмы. Эти естественные механизмы вызывают подобное искажение сегрегации в дикой природе, возникающее, когда аллели развивают молекулярные механизмы, которые дают им шанс передачи, превышающий нормальные 50%.
Большинство генов было разработано у насекомых, особенно у комаров, как способ борьбы с патогенами, переносимыми насекомыми. Однако недавние разработки сконструировали генные двигатели непосредственно в вирусах, особенно герпесвирусах. Эти вирусные генные движения могут распространять модификацию в популяцию вирусов и стремиться снизить инфекционность вируса.
В сексуально- воспроизводя виды, большинство генов присутствует в двух копиях (которые могут быть одинаковыми или разными аллелями ), каждая из которых имеет 50% шанс передачи потомку. Смещая наследование определенных измененных генов, синтетические генные драйвы могут распространять изменения в популяции.
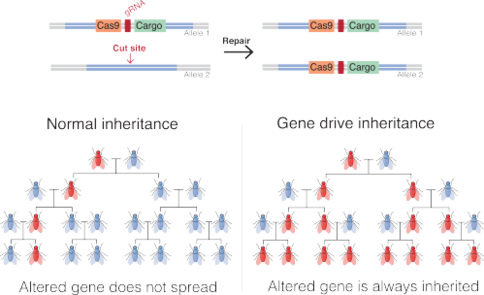
 Молекулярный механизм генного движения.
Молекулярный механизм генного движения. На молекулярном уровне генный драйв эндонуклеаз работает за счет разрезание хромосомы на конкретном участке, который не кодирует диск, побуждая клетку восстановить повреждение путем копирования последовательности диска на поврежденную хромосому. Затем в ячейке есть две копии последовательности дисков. Метод основан на технологиях и основан на том факте, что двухцепочечные разрывы наиболее часто восстанавливаются с помощью гомологичной рекомбинации (в присутствии шаблона), а не негомологичного соединения концов. Для достижения этого поведения механизмы генов эндонуклеаз состоят из двух вложенных элементов:
В результате встраивание генного драйва в геном будет повторяться в каждом организме, который наследует одну копию модификации и одну копию дикого типа ген. Если генный драйв уже присутствует в яйцеклетке (например, когда он получен от одного из родителей), все гаметы индивидуума будут нести генный драйв (вместо 50% в случае нормального гена).
Поскольку он не может более чем удваиваться по частоте с каждым поколением, генный драйв, внедренный у одного человека, обычно требует десятков поколений, чтобы затронуть значительную часть популяции. С другой стороны, выпуск в достаточном количестве организмов, содержащих драйв, может повлиять на остальные в течение нескольких поколений; например, вводя его в каждую тысячную особь, требуется всего 12–15 поколений, чтобы присутствовать у всех особей. Станет ли генный драйв в конечном итоге закрепленным в популяции и с какой скоростью зависит от его влияния на приспособленность людей, скорость преобразования аллелей и структуру популяции. В хорошо перемешанной популяции и с реалистичными частотами конверсии аллелей (≈90%) популяционная генетика предсказывает, что генные двигатели фиксируются для коэффициента отбора меньше 0,3; Другими словами, генные драйвы могут использоваться для распространения модификаций, если репродуктивный успех не снижается более чем на 30%. Это контрастирует с нормальными генами, которые могут распространяться среди больших популяций только в том случае, если они улучшают приспособленность.
Поскольку стратегия обычно основана на одновременном присутствии немодифицированного и генного аллеля в одном и том же ядре клетки, обычно предполагалось, что что генный драйв можно создать только у организмов, воспроизводящихся половым путем, за исключением бактерий и вирусов. Однако во время вирусной инфекции вирусы могут накапливать сотни или тысячи копий генома в инфицированных клетках. Кроме того, клетки часто коинфицируются множеством вирионов, и рекомбинация между вирусными геномами является хорошо известным и широко распространенным источником разнообразия для многих вирусов. В частности, герпесвирусы представляют собой реплицирующиеся в ядре ДНК-вирусы с большими геномами двухцепочечной ДНК и часто подвергаются гомологичной рекомбинации во время цикла репликации.
Эти свойства позволили разработать стратегию генного привода, которая не предполагает половое размножение, но полагается на совместное заражение данной клетки естественным и созданным вирусами. При коинфекции немодифицированный геном разрезается и восстанавливается путем гомологичной рекомбинации, производя новые вирусы, управляющие генами, которые могут постепенно заменять естественную популяцию. В экспериментах на культуре клеток было показано, что вирусный генный драйв может распространяться в вирусной популяции и сильно снижать инфекционность вируса, что открывает новые терапевтические стратегии против герпесвирусов.
Поскольку генные двигатели распространяются путем замены других аллелей, содержащих участок разреза и соответствующие гомологии, их применение в основном ограничивается видами, размножающимися половым путем (поскольку они диплоидны или полиплоид и аллели смешиваются в каждом поколении). В качестве побочного эффекта инбридинг в принципе может быть механизмом ускользания, но степень, в которой это может произойти на практике, трудно оценить.
Из-за количества поколений, необходимых для того, чтобы генный драйв повлиял на весь популяции время до универсальности зависит от репродуктивного цикла каждого вида: для некоторых беспозвоночных может потребоваться менее года, а для организмов с многолетним интервалом между рождением и половым созреванием, например, человека. Следовательно, эта технология наиболее часто используется у быстро размножающихся видов.
Проблемы, выделенные исследователями, включают:
Broad Institute Массачусетского технологического института и Гарвардского университета добавили генные диски к списку применений технологии редактирования генов, которые, по его мнению, компаниям не следует использовать.
Генные побуждения затрагивают все будущие поколения и представляют возможность более значительных изменений в живом виде, чем это было возможно раньше.
В декабре 2015 года ученые ведущих мировых академий призвала к мораторию на наследуемые изменения в геноме человека, которые могут повлиять на зародышевую линию, в том числе связанные с технологиями CRISPR-Cas9, но su Компания pported продолжила фундаментальные исследования и редактирование генов, которые не повлияли бы на будущие поколения. В феврале 2016 года регулирующие органы дали британским ученым разрешение на генетическую модификацию человеческих эмбрионов с помощью CRISPR-Cas9 и связанных с ними методов при условии, что эмбрионы будут уничтожены в течение семи дней. В июне 2016 года Национальные академии наук, инженерии и медицины США опубликовали отчет о своих «Рекомендациях по ответственному поведению» в отношении генных стимулов.
Модели предполагают, что ориентированные на вымирание генные стимулы уничтожит целевые виды, и эти двигатели могут охватить популяции, превышающие цель, при минимальной связи между ними.
Кевин М. Эсвелт заявил, что необходим открытый разговор о безопасности генных двигателей: "На наш взгляд, это разумно предположить, что инвазивные и самораспространяющиеся системы генов могут распространиться на каждую популяцию целевых видов по всему миру. Соответственно, они должны быть построены только для борьбы с настоящими эпидемиями, такими как малярия, для которых у нас мало адекватных мер противодействия и это предлагает реальный путь к международному соглашению для развертывания между всеми затронутыми странами ». Он перешел к открытой модели для своего собственного исследования использования генного влечения для искоренения болезни Лайма в Нантакете и Виноградник Марты. Эсвелт и его коллеги предположили, что CRISPR можно использовать для спасения находящихся под угрозой исчезновения диких животных от исчезновения. Позже Эсвелт отказался от своей поддержки этой идеи, за исключением чрезвычайно опасных популяций, таких как малярийные комары и изолированные острова, которые не позволили бы распространиться за пределы целевой области.
Остин Берт, эволюционный генетик из Имперского колледжа Лондона, представил возможность проведения генов на основе естественной самонаводящейся эндонуклеазы эгоистичных генетических элементов в 2003 году.
Исследователи уже показали, что такие гены могут действовать эгоистично и быстро распространяться среди последующих поколений. Берт предположил, что генный драйв может быть использован для предотвращения передачи популяции комаров малярийного паразита или для уничтожения популяции комаров. Генный драйв на основе самонаводящихся эндонуклеаз был продемонстрирован в лаборатории на трансгенных популяциях комаров и плодовых мух. Однако самонаводящиеся эндонуклеазы специфичны для последовательности. Изменение их специфичности для нацеливания на другие представляющие интерес последовательности остается серьезной проблемой. Возможные применения генного драйва оставались ограниченными до открытия CRISPR и связанных с ним РНК-управляемых эндонуклеаз, таких как Cas9 и Cpf1.
. В июне 2014 г. Всемирная организация здравоохранения (ВОЗ) Специальная программа исследований и подготовки специалистов по тропическим болезням выпустила руководство по оценке генетически модифицированных комаров. В 2013 г. Европейское управление по безопасности пищевых продуктов выпустило протокол экологической оценки всех генетически модифицированных организмов.
Target Malaria, проект, финансируемый Фонд Билла и Мелинды Гейтс инвестировал 75 миллионов долларов в технологию генного привода. По первоначальной оценке фонда, технология будет готова к использованию в полевых условиях к 2029 году где-нибудь в Африке. Однако в 2016 году Гейтс изменил эту оценку на некоторое время в течение следующих двух лет. В декабре 2017 года документы, опубликованные в соответствии с Законом о свободе информации, показали, что DARPA инвестировало 100 миллионов долларов в исследования генного драйва.
Ученые разработали несколько стратегий для поддержания контроля над генными драйвами.
Для того, чтобы влечение дрозофил началось, нужны как минимум тысячи насекомых. Маловероятно, что несколько человек, покинувших целевой регион, распространят влечение.
В 2020 году исследователи сообщили о разработке двух активных элементов, содержащих только направляющую РНК, которые, согласно их исследованию, могут активировать остановка или удаление генов, введенных в популяцию в дикой природе с помощью. Старший автор статьи предупреждает, что две нейтрализующие системы, которые они продемонстрировали в испытаниях клеток, «не должны использоваться с ложным чувством безопасности для полевых генных приводов».
CRISPR - это метод редактирования ДНК, который делает генную инженерию быстрее, проще и эффективнее. Подход включает экспрессию РНК -управляемой эндонуклеазы, такой как Cas9, вместе с направляющими РНК, направляющими ее в конкретную последовательность, подлежащую редактированию. Когда эндонуклеаза разрезает последовательность-мишень, клетка восстанавливает повреждение, заменяя исходную последовательность гомологичной ДНК. Путем введения дополнительной матрицы с подходящими гомологами можно использовать эндонуклеазу для удаления, добавления или модификации генов беспрецедентно простым способом. По состоянию на 2014 год он был протестирован на клетках 20 видов, включая человека. У многих из этих видов правки изменили зародышевую линию организма, позволив им унаследоваться.
В 2014 году Эсвелт и его коллеги впервые предположили, что CRISPR / Cas9 можно использовать для создания генов-приводов эндонуклеаз. В 2015 году исследователи опубликовали успешную разработку генов-драйвов на основе CRISPR у Saccharomyces, Drosophila и комаров. Все четыре исследования продемонстрировали эффективное искажение наследования на протяжении последующих поколений, а одно исследование продемонстрировало распространение генного драйва в лабораторных популяциях. Ожидалось, что аллели устойчивости к драйверу возникнут для каждого из описанных генных влечений, однако это можно было бы отсрочить или предотвратить, нацелив на высококонсервативные сайты, в которых устойчивость, как ожидается, будет иметь серьезные затраты на приспособленность.
Благодаря гибкости таргетинга CRISPR, генные двигатели теоретически могут быть использованы для создания практически любого признака. В отличие от предыдущих разработок, они могут быть адаптированы для блокирования эволюции устойчивости к возбудителям в целевой популяции путем нацеливания на несколько последовательностей в соответствующих генах. CRISPR может позволить использовать различные архитектуры генного привода, предназначенные для управления популяциями, а не для сбоя.
Генные двигатели имеют два основных класса приложений, которые имеют различное значение:
Из-за их беспрецедентного потенциального риска были предложены и протестированы защитные механизмы.
Одним из возможных приложений является генетически модифицировать комаров и других переносчиков болезней, чтобы они не могли передавать такие заболевания, как малярия и лихорадка денге. Исследователи заявили, что, применив эту технику к 1% дикой популяции комаров, они могут искоренить малярию в течение года.
Для уничтожения можно использовать генный драйв инвазивные виды и, например, был предложен как способ устранения инвазивных видов в Новой Зеландии. Генные двигатели в целях сохранения биоразнообразия изучаются в рамках программы «Генетический биоконтроль инвазивных грызунов» (GBIRd), поскольку они позволяют снизить риск для нецелевых видов и снизить затраты по сравнению с традиционными методами удаления инвазивных видов. Учитывая риски такого подхода, описанного ниже, партнерство GBIRd придерживается целенаправленного, поэтапного процесса, который будет осуществляться только после согласования с общественностью, как рекомендовано ведущими мировыми исследователями генного драйва из Национальной академии наук Австралии и США и многие другие. Для повышения осведомленности о ценности исследований генного влечения для общественного блага существует более широкая сеть распространения информации.
Некоторые ученые обеспокоены этим методом, опасаясь, что он может распространиться и уничтожить виды в естественных средах обитания. Ген может мутировать, потенциально вызывая непредвиденные проблемы (как и любой ген). Многие неместные виды могут гибридизоваться с местными видами, так что генный драйв, поражающий неместное растение или животное, гибридизирующееся с местным видом, может обречь местный вид. Многие неместные виды настолько хорошо прижились в своей новой среде, что сельскохозяйственные культуры и / или местные виды адаптировались к зависимости от них.
Проект Predator Free 2050 - это новый Правительственная программа Зеландии по полному уничтожению восьми инвазивных видов хищных млекопитающих (включая крыс, короткохвостых ласок и опоссумов) из страны к 2050 году. Впервые проекты были объявлены в 2016 году премьер-министром Новой Зеландии Джоном Ки и в январе 2017 года было объявлено, что в этих усилиях будет использоваться генный драйв. В 2017 году одна группа в Австралии и другая в Техасе опубликовали предварительные исследования по созданию «мышей без дочерей» с использованием генов у млекопитающих.
В 2017 году ученые из Калифорнийского университета в Риверсайде разработали генное стремление атаковать инвазивную пятнистую дрозофилу, вид плодовой мухи, произрастающей в Азии, которая обходится вишневым фермам Калифорнии в 700 миллионов долларов в год из-за остроугольного хвоста » яйцеклад », уничтожающий безупречный плод. Основная альтернативная стратегия борьбы включает использование инсектицидов, называемых пиретроидов, которые убивают почти всех насекомых, с которыми контактирует.
Трансгуманист философ Дэвид Пирс выступал за использование генов на основе CRISPR для уменьшения страданий диких животных. Кевин М. Эсвелт, американский биолог, который помогал в разработке Технология генного привода утверждала, что существует моральное обоснование устранения мухи с помощью таких технологий из-за огромных страданий, которые испытывают зараженные дикие животные, когда их едят заживо.