Направляющие РНК (также известные как гРНК, sgRNA ) - это РНК, направляют вставку или удаление остатков уридина в митохондриальные мРНК в кинетопластид протистах в процессе, известном как.
Термины «направляющая РНК» и «гРНК» также используются в прокариотических, включая CRISPR и Cas9. Для этой прокариотической системы редактирования ДНК гРНК придает специфичность последовательности-мишени системе CRISPR-Cas9. Эти гРНК представляют собой некодирующие короткие последовательности РНК, которые связываются с комплементарными последовательностями ДНК-мишени. Направляющая РНК сначала связывается с ферментом Cas9, а последовательность гРНК направляет комплекс через спаривание в определенное место на ДНК, где Cas9 выполняет свою эндонуклеазную активность, разрезая цепь ДНК-мишени.
Помимо экспрессии нуклеазы Cas9, системе CRISPR-Cas9 требуется конкретная молекула РНК для рекрутирования и направления нуклеазной активности в интересующую область. Эти направляющие РНК имеют одну из двух форм:
crRNA и tracrRNA образуют комплекс, который действует как направляющая РНК для фермента Cas9. Способность tracrRNA к формированию каркаса вместе со специфичностью crRNA может быть объединена в единую синтетическую gRNA, которая упрощает управление генными изменениями до однокомпонентной системы, которая может повысить эффективность.
Руководство по редактированию РНК РНК было открыто в 1990 г. Б. Блюмом, Н. Бакаларой и Л. Симпсоном из-за их роли в редактировании РНК в митохондриях Leishmania tarentolae. Эти молекулы гРНК кодируются в ДНК максимального кольца в митохондриях, имеющих последовательности, которые комплементарны зрелым мРНК в редактируемых областях. Они участвуют в нескольких действиях по расщеплению, вставке или удалению оснований после образования частичного гибрида между гРНК и предварительно отредактированной мРНК
трипаносоматид протистов и других кинетопластидов имеет новый процесс посттранскрипционной модификации митохондриальной РНК, известный как «редактирование РНК». У них есть большой сегмент высокоорганизованных сегментов ДНК, присутствующих в митохондриях. Эта митохондриальная ДНК имеет круглую форму и существует в одной из двух форм: максициклических или мини-окружностей. На каждую клетку приходится 20-50 максимальных окружностей, имеющих как кодирующие, так и некодирующие области. Кодирующая область является высококонсервативной (16-17 kb), а некодирующая область варьируется в зависимости от вида. Миникруги маленькие, но их больше, чем максикокружностей. Миникольцы составляют 95% массы кинетопластидной ДНК. Maxicircles может кодировать «криптогены » и некоторые гРНК; миникольца могут кодировать большинство гРНК. До 1000 гРНК могут кодироваться 250 или более миникольцами. Некоторые гены гРНК показывают идентичные сайты вставки и делеции, даже если они имеют разные последовательности, тогда как другие последовательности гРНК не комплементарны предварительно отредактированной мРНК. Молекулы максицикольцев и миникольц сцеплены в гигантскую сеть ДНК, которая расположена в основании жгутика во внутреннем отделении единственной митохондрии.
Большинство транскриптов максицикольца не могут транслироваться в белки из-за множественных сдвигов рамки считывания в последовательностях. Эти сдвиги рамки считывания корректируются после транскрипции путем вставки и удаления остатков уридина в точных сайтах, которые создают открытую рамку считывания, которая транслируется в митохондриальный белок, гомологичный митохондриальным белкам из других клеток. Вставки и делеции опосредуются короткой направляющей РНК (gRNA), которая кодирует информацию редактирования в форме комплементарных последовательностей (что позволяет использовать пары оснований GU, а также GC).
Направляющая РНК в основном транскрибируется из межгенной области максимального круга ДНК, и они комплементарны зрелой мРНК. Важно, чтобы гРНК сначала взаимодействовала с предварительно отредактированной мРНК, а затем с ее парой оснований в 5'-области с комплементарной мРНК. 3'-конец гРНК содержит олиго-U-хвост (5-25 нуклеотидов в длину), который является некодируемой областью, но взаимодействует и образует стабильный комплекс с богатой A и G областью мРНК. Этот исходный гибрид помогает в распознавании конкретного сайта мРНК, который нужно редактировать.
Наличие двух геномов в митохондрии, один из которых содержит информацию о последовательности, которая исправляет ошибки в другом геноме, это роман. Редактирование обычно продолжается от 3 'до 5' мРНК. Событие начального редактирования происходит, когда гРНК образует дуплекс РНК с комплементарной последовательностью мРНК сразу после сайта редактирования. Затем это рекрутирует ряд комплексов рибонуклеопротеина, которые направляют расщепление первого ошибочно спаренного основания, соседнего с якорем гРНК-мРНК. Уридили-трансфераза вставляет «U» на 3'-конце, а РНК-лигаза отвечает за соединение двух обрезанных концов. Затем аналогичным образом модифицируется соседний вышестоящий сайт редактирования. Одна гРНК обычно кодирует информацию для нескольких сайтов редактирования («блок редактирования»), редактирование которого дает полный дуплекс гРНК / мРНК. Этот процесс модификации называется исходной моделью каскада ферментов.
В случае «пан-редактируемых» мРНК дуплекс раскручивается, и другая гРНК затем образует дуплекс с отредактированной последовательностью мРНК и инициирует еще один раунд редактирования. Перекрывающиеся gRNA образуют редактирующий «домен». В некоторых генах существует несколько доменов редактирования. Степень редактирования любого конкретного гена варьируется между видами трипаносоматид. Вариация состоит в потере редактирования на 3'-стороне, вероятно, из-за потери классов последовательностей миникольца, которые кодируют специфические гРНК. Модель ретропозиции была предложена для учета частичной, а в некоторых случаях полной потери редактирования в процессе эволюции. Потеря редактирования в большинстве случаев приводит к летальному исходу, хотя потери были замечены в старых лабораторных штаммах. Сохранение редактирования на протяжении долгой эволюционной истории этих древних протистов предполагает наличие избирательного преимущества, точная природа которого все еще не ясна.
Непонятно, почему трипаносоматиды используют такой сложный механизм для производства мРНК. Возможно, он возник в ранних митохондриях предка линии протистов кинтопластид, поскольку он присутствует в бодонидах, которые являются предками трипаносоматид, и может не присутствовать в эвгленоидах, которые произошли от того же общего предка, что и кинетопластиды.
У простейших Leishmania tarentolae 12 из 18 митохондриальных генов редактируются с использованием этого процесса. Один из таких генов - Cyb. На самом деле мРНК редактируется дважды подряд. Для первого редактирования соответствующая последовательность на мРНК выглядит следующим образом:
мРНК 5 'AAAGAAAAGGCUUUAACUUCAGGUUGU 3'
3'-конец используется для закрепления gRNA (gCyb-I gRNA в этом case) спариванием оснований (используются некоторые пары G / U). 5'-конец точно не совпадает, и одна из трех специфических эндонуклеаз расщепляет мРНК в месте несовпадения.
гРНК 3 'AAUAAUAAAUUUUUAAAUAUAAUAGAAAAUUGAAGUUCAGUA 5' мРНК 5 'AA AGAAA AGGC UUUAACUUCAGGUUGU 3'
Теперь мРНК добавляется в последовательность: каждый сайт «восстанавливается», при редактировании каждого сайта последовательно добавляется 53>
gRNA 3 'AAUAAUAAAUUUUUAAAUAUAAUAGAAAAUUGAAGUUCAGUA 5' мРНК 5 'UUAUUAUUUAGAAAUUUAUGUUGUCUUUUUAACUUCAGGUUGU147' <44 конкретный>сайт редактирования>5 'конец этого раздела - это 3' якорь для другой гРНК (gCyb-II gRNA)направляющая РНК у прокариотCRISPR у прокариот
Большинство прокариот, таких как бактерии и archea использует свою адаптивную иммунную систему, используя CRISPR (сгруппированные с регулярными интервалами короткие палиндромные повторы) и фермент cas для обнаружения и удаления чужеродного генетического материала. Когда прокариоты инфицированы бактериофагами, ДНК фага дает короткие кластерные повторы (CRISPR), которые используются для обнаружения и отщепления фрагментов ДНК от фагов аналогичного типа. Этот защитный механизм прокариот используется как метод редактирования, который также может использоваться в процессе генной терапии. Метод редактирования CRISPR Cas использует gRNA для идентификации и расщепления цепей ДНК.
Структура
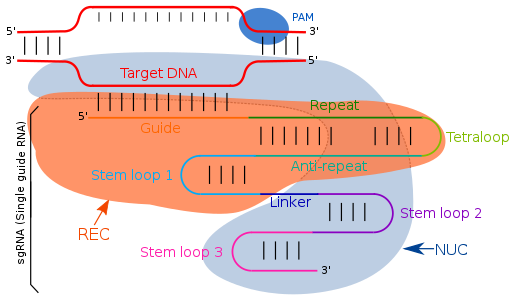
Направляющая РНК нацелена на комплементарные последовательности путем простого спаривания оснований Уотсона-Крика. В системе CRISPR / cas типа II единая направляющая РНК направляет целевые специфические области. Единая направляющая РНК представляет собой искусственно запрограммированную комбинацию двух молекул РНК, один компонент (tracrRNA ) отвечает за активность эндонуклеазы Cas9, а другой (crRNA) связывается с целевой областью ДНК. Следовательно, трансактивирующая РНК (tracrRNA ) и crRNA являются двумя ключевыми компонентами и соединены тетрапетлей, что приводит к образованию sgRNA. ТракрРНК представляют собой пары оснований, имеющие структуру петли сами по себе и прикрепленные к ферменту эндонуклеазой. Транскрипция локуса CRISPR дает РНК CRISPR (crRNA), которая имеет спейсер-фланкированную область из-за повторяющихся последовательностей, состоящих из 18-20 пар оснований. crRNA идентифицирует специфическую комплементарную целевую область, которая расщепляется Cas9 после его связывания с crRNA и tcRNA, которые все вместе известны как эффекторный комплекс. С помощью модификаций в последовательностях crRNA направляющей РНК можно изменить место связывания и, следовательно, определить его как программу, определяемую пользователем.
ПриложенияКонструирование гРНК
Нацеленность CRISPR-Cas9 определяется 20-нуклеотидной последовательностью на 5'-конце гРНК. Желаемая последовательность-мишень должна предшествовать мотиву, прилегающему к протоспейсеру (PAM), который представляет собой короткую последовательность ДНК, обычно длиной 2-6 пар оснований, которая следует за областью ДНК, нацеленной на расщепление системой CRISPR, такой как CRISPR-Cas9. PAM необходим для разрезания нуклеазы Cas и обычно находится на 3–4 нуклеотидах ниже участка разреза. После спаривания оснований гРНК с мишенью Cas9 обеспечивает двухцепочечный разрыв примерно на 3 нуклеотида выше PAM.
Содержание ГХ в направляющей последовательности должно составлять 40-80%. Высокое содержание GC стабилизирует дуплекс РНК-ДНК, дестабилизируя гибридизацию вне мишени. Длина направляющей последовательности должна быть между 17-24 п.о., при этом более короткая последовательность минимизирует эффекты, не соответствующие цели. Направляющие последовательности размером менее 17 пар оснований могут нацеливаться на несколько локусов.
CRISPR Cas9
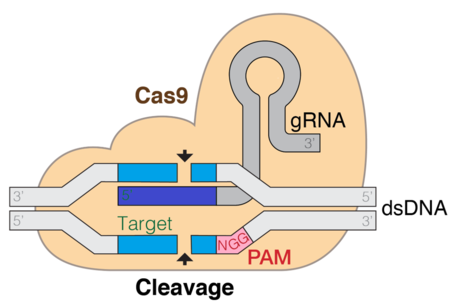
CRISPR (Кластерные короткие палиндромные повторы с регулярными интервалами) / Cas9 - это метод, используемый для редактирования генов и генной терапии. Cas - это фермент эндонуклеаза, который разрезает ДНК в определенном месте, управляемом направляющей РНК. Это специфическая для мишени методика, которая может вызвать нокаут или нокаут гена в зависимости от пути двухцепочечной репарации. Доказательства показывают, что как in vitro, так и in vivo требуется tracrRNA для связывания Cas9 и последовательности ДНК-мишени. Система CRISPR CAS9 состоит из трех основных этапов. Первый этап - расширение оснований в области локуса CRISPR путем добавления спейсеров чужеродной ДНК в последовательность генома. Несколько разных белков, таких как cas1 и cas2, помогают находить новые спейсеры. Следующий этап включает транскрипцию CRISPR: пре-crRNA (предшественник CRISPR РНК) экспрессируется транскрипцией массива повтор-спейсер CRISPR. При дальнейшей модификации пре-crРНК превращаются в единый спейсер, фланкированный областью, с образованием короткой crРНК. Процесс созревания РНК подобен в типах I и II, но отличается в типе III, на этом этапе добавляются аРНК как tracr. Третий этап включает связывание белка cas9 и направление его на расщепление сегмента ДНК. Белок Cas9 связывается с комбинированной формой crRNA и tracrRNA, образуя эффекторный комплекс. Он действует как направляющая РНК для белка cas9, направляя его на его эндонуклеазную активность.
Мутагенез РНК
Одним из важных методов регуляции генов является мутагенез РНК, который может быть введен путем редактирования РНК с помощью гРНК. Направляющая РНК заменяет аденозин на инозин в конкретном целевом сайте и изменяет генетический код. Аденозиндезаминаза действует на РНК, вызывая посттранскрипционную модификацию, изменяя кодоны и различные функции белков. Направляющие РНК - это небольшие РНК ядра ядра, которые вместе с рибопротеинами выполняют внутриклеточные изменения РНК, такие как рибометилирование в рРНК и введение псевдоуридина в прерибосомную РНК. Направляющая РНК связывается с антисмысловой последовательностью РНК и регулирует модификацию РНК. Замечено, что малая интерферирующая РНК (миРНК) и микроРНК (миРНК) обычно используются в качестве последовательности РНК-мишени, и модификации сравнительно легко вводятся из-за небольшого размера.
См. Также