 Капли росы, прилипшие к паутине
Капли росы, прилипшие к паутине  Воспроизвести медиа Адгезия лягушки на мокрой вертикальной стеклянной поверхности. IUPAC определение Процесс прикрепления вещества к поверхности другого вещества.
Воспроизвести медиа Адгезия лягушки на мокрой вертикальной стеклянной поверхности. IUPAC определение Процесс прикрепления вещества к поверхности другого вещества. Примечание 1: для адгезии требуется энергия, которая может исходить от химических и / или физических. связей, причем последняя является обратимой при приложении достаточной энергии.
Примечание 2: В биологии адгезия отражает поведение клеток вскоре после контакта. с поверхностью.
Примечание 3: в хирургии адгезия используется, когда две ткани неожиданно сливаются.Адгезия - это тенденция разнородных частиц или поверхностей прилипать друг к другу (когезия относится к тенденции подобных или идентичных частиц / поверхностей прилипать друг к другу).
силы, вызывающие адгезию и когезию, можно разделить на несколько типов. межмолекулярные силы, ответственные за функцию различных видов наклеек и липкой ленты, попадают в категории, дисперсионная адгезия, и. В дополнение к кумулятивным величинам этих межмолекулярных сил, существуют также определенные эмерджентные.
 Диаграмма различных случаев расщепления с обозначением каждого уникального вида.. A: γ = (1/2) W 11. B: W 12 = γ 1 + γ 2 - γ 12. C: γ 12 = (1/2) W 121 = (1/2) W 212. D: W 12 + W 33 - W 13 - W 23 = W 132.
Диаграмма различных случаев расщепления с обозначением каждого уникального вида.. A: γ = (1/2) W 11. B: W 12 = γ 1 + γ 2 - γ 12. C: γ 12 = (1/2) W 121 = (1/2) W 212. D: W 12 + W 33 - W 13 - W 23 = W 132.Поверхностная энергия обычно определяется как работа, которая требуется для построения области конкретной поверхности. Другой способ увидеть поверхностную энергию - связать ее с работой, необходимой для раскалывания объемного образца, создавая две поверхности. Если новые поверхности идентичны, поверхностная энергия γ каждой поверхности равна половине работы раскола, W: γ = (1/2) W 11.
Если поверхности не равны, уравнение Юнга-Дюпре применяется: W 12 = γ 1 + γ 2 - γ 12, где γ 1 и γ 2 - это поверхностные энергии двух новых поверхностей, а γ 12 - межфазная энергия.
Эту методологию также можно использовать для обсуждения расщепления, которое происходит в другой среде: γ 12 = (1/2) W 121 = (1/2) W 212. Эти две величины энергии относятся к энергии, которая необходима для расщепления одного вида на две части, в то время как она содержится в среде другого вида. Аналогично для трехвидовой системы: γ 13 + γ 23 - γ 12 = W 12 + W 33 - W 13 - W 23 = W 132, где W 132 - энергия отщепления частиц 1 от частиц 2 в среда видов 3.
Базовое понимание терминологии, поверхностной энергии и поверхностного натяжения очень полезно для понимания физического состояния и событий, которые происходят на данной поверхности, но, как обсуждается ниже, теория этих переменных также дает некоторые интересные эффекты, которые касаются практичности адгезионных поверхностей по отношению к их окружению.
Не существует единой теории, охватывающей адгезию, а конкретные механизмы относятся к конкретным материальным сценариям. Было предложено пять механизмов адгезии, чтобы объяснить, почему один материал прилипает к другому:
Адгезивные материалы заполняют пустоты или поры поверхности и удерживают поверхности вместе с помощью блокировки. Другие явления взаимоблокировки наблюдаются на разных масштабах длины. Шитье является примером двух материалов, образующих крупномасштабное механическое соединение, липучка образует один в среднем масштабе, а некоторые текстильные клеи (клей) образуют один в небольшом масштабе.
Два материала могут образовывать соединение в месте соединения. Самые прочные соединения - это места, где атомы двух материалов обмениваются электронами или обмениваются ими (соответственно, это называется ковалентная связь или ионная связь ). Более слабая связь образуется, если атом водорода в одной молекуле притягивается к атому азота, кислорода или фтора в другой. молекулы, явление, называемое водородной связью.
Химическая адгезия возникает, когда две отдельные поверхности образуют ионные, ковалентные или водородные связи. Инженерный принцип химической адгезии в этом смысле довольно прост: если поверхностные молекулы могут связываться, то поверхности будут связаны вместе сетью этих связей. Следует отметить, что эти ионные и ковалентные силы притяжения эффективны только на очень малых расстояниях - менее нанометров. В целом это означает не только то, что поверхности с потенциалом химического связывания должны быть очень близко друг к другу, но также и то, что эти связи являются довольно хрупкими, поскольку в этом случае поверхности необходимо держать близко друг к другу.
При дисперсионной адгезии, также известной как физисорбция, два материала удерживаются вместе силами Ван-дер-Ваальса : притяжением между двумя молекулами, каждая из которых имеет область небольшой положительный и отрицательный заряд. Следовательно, в простом случае такие молекулы полярны относительно средней плотности заряда, хотя в более крупных или более сложных молекулах может быть несколько «полюсов» или областей с большей положительной или отрицательный заряд. Эти положительные и отрицательные полюса могут быть постоянным свойством молекулы (силы Кизома ) или временным эффектом, который может возникнуть в любой молекуле, поскольку случайное движение электронов внутри молекул может привести к временной концентрации электроны в одной области (силы Лондона ).
 Когезия заставляет воду образовывать капли, поверхностное натяжение делает их почти сферическими, а адгезия удерживает капли на месте.
Когезия заставляет воду образовывать капли, поверхностное натяжение делает их почти сферическими, а адгезия удерживает капли на месте.  Капли воды более плоские на цветке гибискуса который показывает лучшую адгезию.
Капли воды более плоские на цветке гибискуса который показывает лучшую адгезию. В Surface Science термин адгезия почти всегда относится к дисперсионной адгезии. В типичной системе твердое тело-жидкость-газ (например, капля жидкости на твердом теле, окруженном воздухом) угол контакта используется для косвенной оценки адгезии, тогда как a позволяет проводить прямые количественные измерения адгезии. Обычно случаи, когда краевой угол смачивания мал, считаются более высокими адгезией на единицу площади. Этот подход предполагает, что меньший контактный угол соответствует более высокой поверхностной энергии. Теоретически более точное соотношение между краевым углом смачивания и работой адгезии является более сложным и определяется уравнением Юнга-Дюпре. Краевой угол трехфазной системы является функцией не только дисперсионной адгезии (взаимодействия между молекулами в жидкости и молекулами в твердом теле), но и когезии (взаимодействия между самими молекулами жидкости). Сильная адгезия и слабая когезия приводят к высокой степени смачивания, лиофильному состоянию с низкими измеренными углами смачивания. И наоборот, слабая адгезия и сильная когезия приводят к условиям с высокими измеренными углами смачивания и плохим смачиванием.
Лондонская дисперсия сил особенно полезна для функции, потому что они не требуют, чтобы ни одна из поверхностей имела постоянную полярность. Они были описаны в 1930-х годах Фрицем Лондоном и наблюдались многими исследователями. Дисперсионные силы являются следствием. Лондон предположил, что силы притяжения между молекулами, которые нельзя объяснить ионным или ковалентным взаимодействием, могут быть вызваны полярными моментами внутри молекул. Мультиполи могут учитывать притяжение между молекулами, имеющими постоянные мультипольные моменты, которые участвуют в электростатическом взаимодействии. Однако экспериментальные данные показали, что многие соединения, испытывающие силы Ван-дер-Ваальса, вообще не имеют мультиполей. Лондон предположил, что мгновенные диполи индуцируются исключительно благодаря близости молекул друг к другу. Решив квантово-механическую систему двух электронов как гармонических осцилляторов на некотором конечном расстоянии друг от друга, смещенных относительно их соответствующих положений покоя и взаимодействующих с полями друг друга, Лондон показал, что энергия этой системы задана по:

В то время как первый член - это просто энергия нулевой точки, отрицательный второй член описывает силу притяжения между соседними осцилляторами. Тот же аргумент может быть распространен на большое количество связанных осцилляторов и, таким образом, обходит проблемы, которые, в частности, свели бы на нет крупномасштабные эффекты притяжения постоянных диполей, компенсирующих симметрию.
Аддитивный характер дисперсионного эффекта имеет еще одно полезное следствие. Рассмотрим один такой дисперсионный диполь , называемый диполем начала координат. Поскольку любой исходный диполь по своей природе ориентирован так, чтобы его притягивали к соседним диполям, которые он индуцирует, в то время как другие, более удаленные диполи не коррелируют с исходным диполем никаким фазовым соотношением (таким образом, в среднем не вносят никакого вклада), возникает чистая привлекательная сила в массе таких частиц. При рассмотрении идентичных частиц это называется силой сцепления.
При обсуждении адгезии эту теорию необходимо преобразовать в термины, относящиеся к поверхностям. Если есть чистая привлекательная энергия когезии в объеме подобных молекул, то расщепление этого объема для образования двух поверхностей даст поверхности с дисперсионной поверхностной энергией, поскольку форма энергии остается той же самой. Эта теория обеспечивает основу для существования сил Ван-дер-Ваальса на поверхности, которые существуют между любыми молекулами, имеющими электронов. Эти силы легко наблюдаются посредством самопроизвольного перехода гладких поверхностей в контакт. Гладкие поверхности слюды, золота, различных полимеров и твердых растворов желатина не разделяются, когда их разделение становится достаточно небольшим - порядка 1–10 нм. Уравнение, описывающее эти достопримечательности, было предсказано в 1930-х годах Де Боером и Хамакером:

где P - сила (отрицательная для притяжения), z - расстояние разделения, а A - константа для конкретного материала, называемая постоянной Гамакера.
 две стадии коллапса микроструктуры PDMS из-за притяжения Ван-дер-Ваальса. Штамп PDMS обозначен заштрихованной областью, а подложка обозначена заштрихованной областью. А) Штамп ПДМС помещается на подложку с приподнятой «крышей». Б) Аттракционы Ван-дер-Ваальса делают обрушение крыши энергетически выгодным для штампа PDMS.
две стадии коллапса микроструктуры PDMS из-за притяжения Ван-дер-Ваальса. Штамп PDMS обозначен заштрихованной областью, а подложка обозначена заштрихованной областью. А) Штамп ПДМС помещается на подложку с приподнятой «крышей». Б) Аттракционы Ван-дер-Ваальса делают обрушение крыши энергетически выгодным для штампа PDMS. Эффект также очевиден в экспериментах, где штамп полидиметилсилоксан (PDMS) изготавливается с небольшими периодическими столбчатыми структурами. Поверхность со стойками помещается лицевой стороной вниз на гладкую поверхность, так что площадь поверхности между стойками возвышается над гладкой поверхностью, как крыша, поддерживаемая колоннами. Из-за этих притягивающих дисперсионных сил между PDMS и гладкой подложкой возвышенная поверхность - или «крыша» - обрушивается на подложку без какой-либо внешней силы, кроме притяжения Ван-дер-Ваальса. Простые гладкие полимерные поверхности - без каких-либо микроструктур - обычно используются для этих дисперсионных адгезионных свойств. Наклейки и наклейки, которые приклеиваются к стеклу без использования каких-либо химических клеев, довольно распространены в качестве игрушек и украшений и полезны в качестве съемных этикеток, поскольку они не теряют быстро свои адгезионные свойства, как липкие ленты которые используют клеящие химические соединения.
Важно отметить, что эти силы также действуют на очень малых расстояниях - 99% работы, необходимой для разрыва ван-дер-ваальсовых связей, выполняется, когда поверхности растягиваются на расстояние более нанометра. В результате этого ограниченного движения как в ван-дер-ваальсовых ситуациях, так и в ситуациях ионно-ковалентного связывания, практическая эффективность адгезии из-за одного или обоих этих взаимодействий оставляет желать лучшего. Как только трещина возникает, она легко распространяется вдоль границы раздела из-за хрупкой природы межфазных связей.
В качестве дополнительного следствия увеличение площади поверхности часто мало способствует повышению прочности адгезия в этой ситуации. Это следует из вышеупомянутого разрушения трещины - напряжение на границе раздела не распределяется равномерно, а скорее сосредоточено в области разрушения.
Некоторые проводящие материалы могут пропускать электроны, создавая разницу в электрический заряд на стыке. Это приводит к структуре, подобной конденсатору , и создает притягивающую электростатическую силу между материалами.
Некоторые материалы могут сливаться в стыке в результате диффузии. Это может происходить, когда молекулы обоих материалов подвижны и растворимы друг в друге. Это было бы особенно эффективно с полимерными цепями, где один конец молекулы диффундирует в другой материал. Это также механизм, участвующий в спекании. Когда порошки металла или керамики сжимаются и нагреваются, атомы диффундируют от одной частицы к другой. Это объединяет частицы в одну.
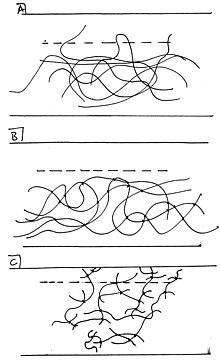 Интерфейс обозначен пунктирной линией. A) Несшитые полимеры могут свободно диффундировать через поверхность раздела. Видны рассеивающиеся одна петля и два дистальных хвоста. Б) Сшитые полимеры недостаточно свободны для диффузии. C) Полимеры с «ножницами» очень свободны, с множеством хвостов, проходящих через поверхность раздела.
Интерфейс обозначен пунктирной линией. A) Несшитые полимеры могут свободно диффундировать через поверхность раздела. Видны рассеивающиеся одна петля и два дистальных хвоста. Б) Сшитые полимеры недостаточно свободны для диффузии. C) Полимеры с «ножницами» очень свободны, с множеством хвостов, проходящих через поверхность раздела. Диффузионные силы чем-то похожи на механическое связывание на молекулярном уровне. Диффузионное связывание происходит, когда частицы с одной поверхности проникают на соседнюю поверхность, все еще будучи связанными с фазой своей поверхности происхождения. Один поучительный пример - это поверхность полимера на полимере. Диффузионное связывание на поверхностях полимер-полимер является результатом пересечения полимерных цепей на одной поверхности с таковыми на соседней поверхности. Свобода движения полимеров оказывает сильное влияние на их способность встречаться между собой и, следовательно, на диффузионное связывание. Например, сшитые полимеры менее способны к диффузии и потому, что они связаны друг с другом во многих точках контакта и не могут свободно скручиваться в прилегающую поверхность. Не сшитые полимеры (термопласты ), с другой стороны, более свободно переходят в соседнюю фазу, протягивая хвосты и петли через поверхность раздела.
Еще одним обстоятельством, при котором возникает диффузное связывание, является «разрыв». Разрыв цепи - это разрезание полимерных цепей, приводящее к более высокой концентрации дистальных хвостов. Повышенная концентрация этих концов цепи приводит к повышенной концентрации полимерных хвостов, проходящих через поверхность раздела. Разрыв легко достигается с помощью ультрафиолетового облучения в присутствии газообразного кислорода, что позволяет предположить, что адгезивные устройства, использующие диффузионное связывание, действительно выигрывают от длительного воздействия тепла / света и воздуха. Чем дольше такое устройство находится в этих условиях, тем больше хвостов разрезается и разветвляется через интерфейс.
Попав через интерфейс, хвосты и петли образуют любые благоприятные связи. В случае поверхностей полимер-на-полимере это означает большие силы Ван-дер-Ваальса. Хотя они могут быть хрупкими, они довольно прочные, когда образуется большая сеть этих связей. Самый внешний слой каждой поверхности играет решающую роль в адгезионных свойствах таких границ раздела, поскольку даже небольшое количество пересечений - всего лишь один или два хвоста длиной 1,25 ангстрем - может увеличить ван-дер-ваальсовы связи на порядок величины..
Прочность адгезии между двумя материалами зависит от того, какой из вышеперечисленных механизмов происходит между двумя материалами, и от площади поверхности, на которой два материала контактируют. Материалы, которые смачиваются друг напротив друга, имеют большую площадь контакта, чем те, которые не смачиваются. Смачивание зависит от поверхностной энергии материалов.
Материалы с низкой поверхностной энергией, такие как полиэтилен, полипропилен, политетрафторэтилен и полиоксиметилен, трудно склеить без специальной поверхности. подготовка.
Еще одним фактором, определяющим прочность адгезионного контакта, является его форма. Клейкие контакты сложной формы начинают отслаиваться на «краях» контактной площадки. На пленке можно увидеть процесс разрушения адгезионных контактов.
В сочетании с первичными поверхностными силами, описанными выше, существует несколько косвенных эффектов. Хотя каждая из этих сил влияет на величину сцепления между поверхностями, следующие факторы играют решающую роль в общей прочности и надежности клеевого устройства.
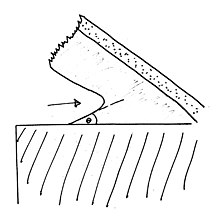 Процесс аппликатуры. Заштрихованная область - это принимающая подложка, пунктирная полоса - это лента, а заштрихованная область между ними - клейкий химический слой. Стрелка указывает направление распространения трещины.
Процесс аппликатуры. Заштрихованная область - это принимающая подложка, пунктирная полоса - это лента, а заштрихованная область между ними - клейкий химический слой. Стрелка указывает направление распространения трещины. , возможно, является наиболее важным из этих эффектов, и его часто можно увидеть на липких лентах. Образование струн возникает, когда начинается разделение двух поверхностей и молекулы на границе раздела переходят через зазор, а не растрескиваются, как сама поверхность раздела. Наиболее значимое последствие этого эффекта - сдерживание трещины. Обеспечивая в противном случае хрупкие межфазные связи с некоторой гибкостью, молекулы, натянутые через зазор, могут остановить распространение трещины. Другой способ понять это явление - сравнить его с концентрацией напряжений в точке разрушения, упомянутой ранее. Так как напряжение теперь распространяется на некоторую область, напряжение в любой данной точке имеет меньше шансов преодолеть общую силу сцепления между поверхностями. Если разрушение действительно происходит на границе раздела, содержащего вязкоупругий адгезивный агент, и трещина действительно распространяется, это происходит в результате постепенного процесса, называемого «аппликатурой», а не быстрого хрупкого разрушения. Нанизывание может применяться как к режиму диффузионного связывания, так и к режиму химического связывания. Цепочки молекул, перекрывающие зазор, будут либо молекулами, которые ранее диффундировали через поверхность раздела, либо вязкоупругим клеем, при условии, что на границе раздела имеется значительный его объем.
Известно, что взаимодействие механизмов молекулярного масштаба и иерархических поверхностных структур приводит к высоким уровням статического трения и сцепления между парами поверхностей. Технологически продвинутые клеящие устройства иногда используют микроструктуры на поверхностях, например, плотно упакованные периодические штифты. Эти биомиметические технологии, вдохновленные адгезивными способностями ног различных членистоногих и позвоночных (в первую очередь, гекконов ). Перемешивая периодические разрывы в гладкие, клейкие поверхности, поверхность раздела приобретает ценные свойства предотвращения трещин. Поскольку зарождение трещины требует гораздо большего напряжения, чем распространение трещины, такие поверхности гораздо труднее отделить, так как новая трещина должна запускаться заново каждый раз, когда достигается следующая отдельная микроструктура.
Гистерезис, в данном случае, относится к реструктуризации адгезивной поверхности раздела в течение некоторого периода времени, в результате чего работа, необходимая для разделения двух поверхностей, больше, чем работа, которая была получена путем их объединения (W>γ 1 + γ 2). По большей части это явление связано с диффузной связью. Чем больше времени дается паре поверхностей, демонстрирующих диффузионное связывание, для реструктуризации, тем больше будет происходить диффузия, тем сильнее станет адгезия. Вышеупомянутая реакция определенных поверхностей полимер на полимере на ультрафиолетовое излучение и газообразный кислород является примером гистерезиса, но она также будет происходить со временем без этих факторов.
В дополнение к возможности наблюдать гистерезис, определяя, истинно ли W>γ 1 + γ 2, его можно также найти, выполнив команду «stop -старт »измерений. В этих экспериментах две поверхности непрерывно скользят друг по другу и иногда останавливаются на определенное время. Результаты экспериментов с поверхностями полимер-на-полимере показывают, что если время остановки достаточно короткое, возобновление плавного скольжения легко. Если, однако, время остановки превышает некоторый предел, возникает первоначальное увеличение сопротивления движению, что указывает на то, что времени остановки было достаточно для реструктуризации поверхностей.
Некоторые атмосферные воздействия на функциональность клеящих устройств можно охарактеризовать, следуя теории поверхностной энергии и межфазного натяжения. Известно, что γ 12 = (1/2) W 121 = (1/2) W 212. Если γ 12 высокий, то каждый вид считает, что предпочтительнее объединяться во время контакта с чужеродным видом, чем диссоциировать и смешиваться с другим. Если это так, то из этого следует, что при высоком межфазном натяжении сила адгезии мала, поскольку каждый вид не считает возможным связывание друг с другом. Межфазное натяжение жидкости и твердого вещества напрямую связано с смачиваемостью жидкости (по сравнению с твердым телом), и, таким образом, можно экстраполировать, что когезия увеличивается в несмачивающих жидкостях и уменьшается в смачивающих жидкостях. Одним из примеров, подтверждающих это, является каучук полидиметилсилоксан, который имеет работу самоприлипания 43,6 мДж / м на воздухе, 74 мДж / м в воде (несмачивающая жидкость) и 6 мДж / м в метаноле. (смачивающая жидкость).
Этот аргумент может быть расширен до идеи о том, что, когда поверхность находится в среде, с которой связывание является благоприятным, вероятность ее прилипания к другой поверхности меньше, поскольку среда занимает потенциальные сайты на поверхность, которая иначе была бы доступна для приклеивания к другой поверхности. Естественно, это очень сильно относится к смачивающим жидкостям, но также и к молекулам газа, которые могут адсорбироваться на рассматриваемой поверхности, тем самым занимая потенциальные места адгезии. Последний пункт на самом деле довольно интуитивно понятен: если клей слишком долго подвергается воздействию воздуха, он загрязняется, и его адгезионная сила снижается. Это наблюдается в эксперименте: когда слюда раскалывается на воздухе, ее энергия расщепления, W 121 или W слюда / воздух / слюда, меньше, чем энергия расщепления в вакууме, Вт слюда / вакуум / слюда, в 13 раз.
Боковая адгезия - это адгезия, связанная со скольжением одного объекта по подложка, например, скольжение капли по поверхности. Когда два объекта являются твердыми телами, либо с жидкостью между ними, либо без нее, боковая адгезия описывается как трение. Однако поведение боковой адгезии между каплей и поверхностью трибологически сильно отличается от трения между твердыми телами, а естественный адгезионный контакт между плоской поверхностью и каплей жидкости делает боковую адгезию в этом случае индивидуальное поле. Боковое сцепление можно измерить с помощью (CAB), который использует комбинацию центробежных и гравитационных сил для разделения нормальных и боковых сил в проблеме.