Физисорбция, также называемая физической адсорбцией, представляет собой процесс, в котором электронная структура атома или молекула почти не возмущается при адсорбции.
Фундаментальная сила взаимодействия при физической сорбции - Ван-дер-Ваальс (VDW). Несмотря на то, что энергия взаимодействия очень мала (~ 10–100 мэВ), физадсорбция играет важную роль в природе. Например, притяжение Ван-дер-Ваальса между поверхностями и волосками на ногах гекконов обеспечивает замечательную способность взбираться по вертикальным стенам. Силы Ван-дер-Ваальса возникают из-за взаимодействий между индуцированными, постоянными или переходными электрическими диполями.
По сравнению с хемосорбцией, при которой электронная структура связывающих атомов или молекул изменяется и образуются ковалентные или ионные связи, физическая сорбция не приводит к изменениям в структуре химической связи. На практике отнесение конкретной адсорбции к физической адсорбции или хемосорбции зависит главным образом от энергии связи адсорбата с субстратом, причем физическая адсорбция намного слабее в расчете на один атом, чем любой тип соединения, включающего химическая связь.
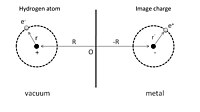 Рис. 1. Схематическое изображение адсорбированного атома водорода около идеального проводника, взаимодействующего с его зарядами изображения.
Рис. 1. Схематическое изображение адсорбированного атома водорода около идеального проводника, взаимодействующего с его зарядами изображения.. Чтобы дать простую иллюстрацию физадсорбции, мы можем сначала рассмотреть адсорбированный атом водорода перед идеальный проводник, как показано на рис. 1. Ядро с положительным зарядом расположено в R = (0, 0, Z), а координата положения его электрона r = (x, y, z) дано относительно ядра. Процесс адсорбции можно рассматривать как взаимодействие между этим атомом водорода и его изображающими зарядами как ядра, так и электрона в проводнике. В результате полная электростатическая энергия является суммой составляющих притяжения и отталкивания:

Первый член - это притягивающее взаимодействие ядра и заряда его изображения, а второй Член обусловлен взаимодействием электрона и его заряда изображения. Отталкивающее взаимодействие показано в третьем и четвертом членах, возникающих из взаимодействия между ядром и электроном изображения и взаимодействия между электроном и ядром изображения, соответственно.
По разложению Тейлора в степенях | r | / | R |, эта энергия взаимодействия может быть дополнительно выражена как:

Можно найти из первого ненулевого члена, что физадсорбционный потенциал зависит от расстояния Z между адсорбированным атомом и поверхностью как Z, в отличие от зависимости от r молекулярного ван-дер-ваальсова потенциала, где r - расстояние между два диполя.
Энергия связи Ван-дер-Ваальса может быть проанализирована с помощью другой простой физической картины: моделирование движения электрона вокруг его ядра с помощью трехмерного простого гармонического осциллятора с потенциальной энергией V a:

где m e и ω - масса и частота колебаний электрона, относительно ively.
Когда этот атом приближается к поверхности металла и образует адсорбцию, эта потенциальная энергия V a будет изменена из-за зарядов изображения дополнительными потенциальными членами, квадратичными по смещениям:
 (из приведенного выше разложения Тейлора.)
(из приведенного выше разложения Тейлора.)Предполагая

the потенциал хорошо аппроксимируется как
 ,
,где

Если предположить, что электрон находится в основном состоянии, то энергия связи Ван-дер-Ваальса по сути является изменением энергии нулевой точки:

Это выражение также показывает характер Z-зависимости ван-дер-ваальсова взаимодействия.
Кроме того, введя атомарную поляризуемость,

потенциал Ван-дер-Ваальса можно еще больше упростить:

где

- это постоянная Ван-дер-Ваальса, которая связана с атомной поляризуемостью.
Кроме того, выражая поправку четвертого порядка в разложении Тейлора выше как (aC vZ0) / (Z), где a - некоторая константа, мы можем определить Z 0 как положение плоскости динамического изображения и получить
| He | Ne | Ar | Kr | Xe | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Cv | Z0 | Cv | Z0 | Cv | Z0 | Cv | Z0 | Cv | Z0 | |
| Cu | 0,225 | 0,22 | 0,452 | 0,21 | 1,501 | 0,26 | 2,11 | 0,27 | 3,085 | 0,29 |
| Ag | 0,249 | 0,2 | 0,502 | 0,19 | 1,623 | 0,24 | 2,263 | 0,25 | 3,277 | 0,27 |
| Au | 0,274 | 0,16 | 0,554 | 0,15 | 1,768 | 0,19 | 2,455 | 0,2 | 3,533 | 0,22 |

Происхождение Z 0 происходит от выброса волновой функции электрона за пределы поверхности. В результате положение плоскости изображения, представляющей опорную точку для пространственной координаты, отличается от самой поверхности подложки и модифицировано Z 0.
. В таблице 1 показан расчет модели желе для постоянной Ван-дер-Ваальса C v и плоскость динамического изображения Z 0 атомов инертных газов на различных металлических поверхностях. Увеличение C v от He до Xe для всех металлических подложек вызвано большей атомной поляризуемостью более тяжелых атомов инертного газа. Что касается положения плоскости динамического изображения, оно уменьшается с увеличением диэлектрической функции и обычно составляет порядка 0,2 Å.
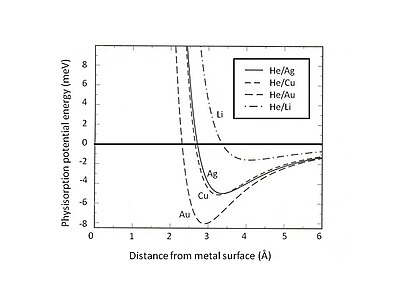 Рис. 2. Расчетная физическая энергия потенциальной адсорбции He, адсорбированного на различных металлических поверхностях желе. Обратите внимание, что слабое притяжение Ван-дер-Ваальса образует мелкие ямы с энергией около нескольких мэВ.
Рис. 2. Расчетная физическая энергия потенциальной адсорбции He, адсорбированного на различных металлических поверхностях желе. Обратите внимание, что слабое притяжение Ван-дер-Ваальса образует мелкие ямы с энергией около нескольких мэВ. Несмотря на то, что ван-дер-ваальсово взаимодействие является привлекательным, по мере приближения адсорбированного атома к поверхности волновая функция электрона начинается перекрываться с поверхностными атомами. В дальнейшем энергия системы будет увеличиваться за счет ортогональности волновых функций приближающегося атома и атомов поверхности.
Это исключение Паули и отталкивание особенно сильны для атомов с замкнутыми валентными оболочками, которые доминируют при поверхностном взаимодействии. В результате минимальная энергия физической адсорбции должна быть найдена за счет баланса между дальнодействующим ван-дер-ваальсовым притяжением и ближним отталкиванием Паули. Например, разделив полное взаимодействие физической адсорбции на два вклада - краткосрочный член, описываемый теорией Хартри-Фока и дальнодействующее ван-дер-ваальсово притяжение, - равновесное положение физадсорбции для адсорбированных инертных газов на субстрате желе. На рис. 2 показана потенциальная энергия физической адсорбции He, адсорбированного на подложках Ag, Cu и Au, которые описываются моделью jellium с различными плотностями размытых фоновых положительных зарядов. Можно обнаружить, что слабое ван-дер-ваальсово взаимодействие приводит к неглубоким притягивающим энергетическим ямам (<10 meV). One of the experimental methods for exploring physisorption potential energy is the scattering process, for instance, inert gas atoms scattered from metal surfaces. Certain specific features of the interaction potential between scattered atoms and surface can be extracted by analyzing the experimentally determined angular distribution and cross sections of the scattered particles.
С 1980 года разрабатывались две теории для объяснения адсорбции и получения уравнений Эти две теории называются гипотезой ци, квантово-механическим выводом, и избыточной работой поверхности, ESW. Обе эти теории приводят к одному и тому же уравнению для плоских поверхностей:
где U - функция единичного шага. Определения другого следующие символы:
 Рис. 3.
Рис. 3.  - график данных DA Payne, KSW Sing, DH Turk (J. Colloid Interface Sci. 43 (1973) 287.), который использовался для создания т.е. график
- график данных DA Payne, KSW Sing, DH Turk (J. Colloid Interface Sci. 43 (1973) 287.), который использовался для создания т.е. график  -s.
-s.  -plot отлично подходит для всей изотермы.
-plot отлично подходит для всей изотермы. где «ad» означает «адсорбированный», «m» означает «монослойный эквивалент» и "vap" относится к давлению пара жидкого адсорбента при той же температуре, что и твердый образец. Единичная функция создает определение молярной энергии адсорбции для первой адсорбированной молекулы следующим образом:
График зависимости 



Типичная аппроксимация хороших данных на однородной непористой поверхности показана на рисунке 3. Данные предоставлены Пейном, Сингом и Тёрком и использовались для создания 