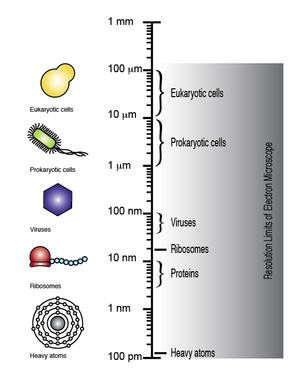
 Электронный микроскоп может достигать разрешения до 100 пикометров, что позволяет эукариотическим клеткам, прокариотам клетки, вирусы, рибосомы и даже отдельные атомы, подлежащие визуализации (обратите внимание на логарифмическую шкалу ).
Электронный микроскоп может достигать разрешения до 100 пикометров, что позволяет эукариотическим клеткам, прокариотам клетки, вирусы, рибосомы и даже отдельные атомы, подлежащие визуализации (обратите внимание на логарифмическую шкалу ).Трансмиссионная электронная микроскопия Секвенирование ДНК - это секвенирование одной молекулы технология, в которой используются методы просвечивающей электронной микроскопии. Метод был задуман и разработан в 1960-х и 1970-х годах, но потерял популярность, когда стала известна степень повреждения образца.
Для ДНК чтобы его можно было четко увидеть под электронным микроскопом, он должен быть помечен тяжелыми атомами. Кроме того, для получения разрешения <55 полезны специальные методы визуализации и оптика с коррекцией аберрации.>требуется для изображения меченой молекулы ДНК. Теоретически секвенирование ДНК с помощью просвечивающей электронной микроскопии может d обеспечивают чрезвычайно большую длину считывания, но проблема повреждения электронного пучка может все еще оставаться, а технология еще не получила коммерческого развития.
Всего несколько лет спустя Джеймс Уотсон и Фрэнсис Крик вывели структуру ДНК, а почти за два десятилетия до Фредерик Сэнджер опубликовал первый метод быстрого Секвенирование ДНК, Ричард Фейнман, американский физик, считал электронный микроскоп инструментом, который однажды позволит биологам «увидеть порядок оснований в цепочке ДНК ». Фейнман считал, что если электронный микроскоп можно сделать достаточно мощным, то станет возможным визуализировать атомную структуру любых химических соединений, включая ДНК.
В 1970 году Альберт Крю разработал метод получения изображений с высоким углом кольцевого темного поля (HAADF) в растровом просвечивающем электронном микроскопе. Используя эту технику, он визуализировал отдельные тяжелые атомы на тонких пленках аморфного углерода. В 2010 году Криванек и его коллеги сообщили о нескольких технических усовершенствованиях метода HAADF, включая сочетание электронной оптики с коррекцией аберрации и низкого ускоряющего напряжения. Последнее имеет решающее значение для визуализации биологических объектов, так как позволяет уменьшить повреждение луча и увеличить контраст изображения для легких атомов. В результате можно было отобразить замещения отдельных атомов в монослое нитрида бора.
Несмотря на изобретение множества химических и флуоресцентных технологий секвенирования, электронная микроскопия все еще исследуется как средство получения одномолекулярной ДНК. последовательность действий. Например, в 2012 году в результате сотрудничества ученых из Гарвардского университета, Университета Нью-Гэмпшира была продемонстрирована способность читать длинные последовательности ДНК с использованием этой техники, однако секвенирование ДНК с помощью просвечивающей электронной микроскопии технология все еще далека от коммерческой доступности.
Электронный микроскоп имеет возможность получить разрешение до 100 мкм, посредством чего микроскопические биомолекулы и структуры, такие как можно наблюдать вирусы, рибосомы, белки, липиды, небольшие молекулы и даже отдельные атомы.
Хотя ДНК видна при наблюдении в электронный микроскоп, разрешение полученного изображения не достаточно высокий, чтобы позволить расшифровать последовательность отдельных оснований, то есть секвенирование ДНК. Однако при дифференциальной маркировке оснований ДНК тяжелыми атомами или металлами можно как визуализировать, так и различать отдельные основания. Таким образом, электронная микроскопия в сочетании с дифференциальной маркировкой тяжелых атомов ДНК может использоваться для прямого изображения ДНК с целью определения ее последовательности.
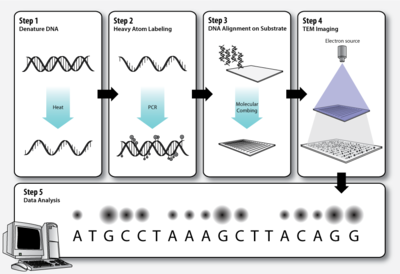 Рабочий процесс секвенирования ДНК с помощью просвечивающей электронной микроскопии
Рабочий процесс секвенирования ДНК с помощью просвечивающей электронной микроскопии Как и в стандартной полимеразной цепной реакции (ПЦР), секвенируемые двухцепочечные молекулы ДНК должны быть денатурированы перед вторая цепь может быть синтезирована с мечеными нуклеотидами.
Элементы, составляющие биологические молекулы (C, H, N, O, P, S ), слишком легкие (низкий атомный номер, Z ), чтобы их можно было четко визуализировать как отдельные атомы с помощью просвечивающей электронной микроскопии. Чтобы обойти эту проблему, ДНК основания могут быть помечены более тяжелыми атомами (более высокое Z). Каждый нуклеотид помечен характерной тяжелой меткой, чтобы их можно было различить на микрофотографии просвечивающего электронного микроскопа.
Молекулы ДНК необходимо растянуть на тонком, твердая подложка, чтобы порядок помеченных оснований был четко виден на электронной микрофотографии. Молекулярное расчесывание - это метод, который использует силу удаляющейся границы раздела воздух-вода для удлинения молекул ДНК, оставляя их необратимо связанными со слоем силана после высыхания. Это одно из средств, с помощью которого может быть достигнуто выравнивание ДНК на твердом субстрате.
 Электронно-микроскопическое изображение ДНК: единицы рибосомной транскрипции Chironomus pallidivitatus. Это изображение было записано с помощью относительно старой технологии (примерно 2005 г.).
Электронно-микроскопическое изображение ДНК: единицы рибосомной транскрипции Chironomus pallidivitatus. Это изображение было записано с помощью относительно старой технологии (примерно 2005 г.). Просвечивающая электронная микроскопия (ПЭМ) дает большое увеличение изображения с высоким разрешением путем пропускания пучка электронов через очень тонкий образец. В то время как атомное разрешение было продемонстрировано с помощью обычного ПЭМ, дальнейшее улучшение пространственного разрешения требует исправления сферических и хроматических аберраций линз микроскопа. Это было возможно только в сканирующей просвечивающей электронной микроскопии, где изображение получают путем сканирования объекта точно сфокусированным электронным лучом, аналогично электронно-лучевой трубке. Однако достигнутое улучшение разрешения сопровождается облучением исследуемого объекта гораздо более высокой интенсивностью луча, сопутствующим повреждением образца и связанными с этим артефактами изображения. В зависимости от того, содержит ли образец тяжелые или легкие атомы, применяются различные методы визуализации:
Темные и светлые пятна на электронной микрофотографии, соответствующие дифференциально меченые основания ДНК анализируются с помощью компьютерного программного обеспечения.
Секвенирование ДНК с помощью просвечивающей электронной микроскопии еще не доступно на коммерческой основе, но большая длина считывания, которую эта технология может однажды обеспечить, сделает ее полезной в различных контекстах.
При секвенировании генома его необходимо разбить на части, достаточно короткие, чтобы их можно было секвенировать за одно считывание. Затем эти чтения необходимо собрать вместе, как мозаику, выровняв области, перекрывающиеся между чтениями; этот процесс называется de novo сборкой генома. Чем больше длина считывания, которую предоставляет платформа для секвенирования, тем длиннее перекрывающиеся области и тем легче собрать геном. С вычислительной точки зрения микрофлюидное секвенирование по Сэнгеру по-прежнему является наиболее эффективным способом секвенирования и сборки геномов, для которых не существует последовательности эталонного генома. Относительно большие длины считывания обеспечивают существенное перекрытие между отдельными считываниями секвенирования, что позволяет повысить статистическую достоверность сборки. Кроме того, длинные чтения по Сэнгеру способны охватывать большинство областей повторяющейся последовательности ДНК, что в противном случае затрудняет сборку последовательности, вызывая ложное выравнивание. Однако сборка генома de novo с помощью секвенирования по Сэнгеру чрезвычайно дорога и требует много времени. Технологии секвенирования второго поколения, хотя и менее дороги, обычно не подходят для сборки генома de novo из-за малой длины считывания. В целом технологии секвенирования третьего поколения, включая секвенирование ДНК с помощью просвечивающей электронной микроскопии, направлены на увеличение длины считывания при сохранении низкой стоимости секвенирования. Таким образом, по мере совершенствования технологий секвенирования третьего поколения, быстрая и недорогая сборка генома de novo станет реальностью.
A гаплотип - это серия связанных аллелей, которые вместе наследуются на одной хромосоме. Секвенирование ДНК можно использовать для генотипа всех однонуклеотидных полиморфизмов (SNP), которые составляют гаплотип. Однако короткие считывания секвенирования ДНК часто не могут быть поэтапными; то есть гетерозиготные варианты нельзя с уверенностью отнести к правильному гаплотипу. Фактически, гаплотипирование с использованием данных секвенирования ДНК с коротким считыванием требует очень высокого охвата (в среднем>50-кратное покрытие каждой базы ДНК) для точной идентификации SNP, а также дополнительных данных последовательности от родителей, чтобы Менделирующая передача могла быть используется для оценки гаплотипов. Технологии секвенирования, которые генерируют длинные считывания, в том числе секвенирование ДНК с помощью просвечивающей электронной микроскопии, могут захватывать целые гаплоблоки за одно считывание. То есть гаплотипы не разбиваются на несколько считываний, и генетически связанные аллели остаются вместе в данных секвенирования. Следовательно, длинные чтения делают гаплотипирование более простым и точным, что полезно в области популяционной генетики.
Гены обычно присутствуют в двух копиях в диплоиде геном человека; гены, которые отклоняются от этого стандартного числа копий, называются вариантами числа копий (CNV). Вариация числа копий может быть доброкачественной (обычно это распространенные варианты, называемые полиморфизмом числа копий) или патогенными. CNV обнаруживают с помощью флуоресцентной гибридизации in situ (FISH) или сравнительной геномной гибридизации (CGH). Для обнаружения конкретных контрольных точек, в которых происходит делеция, или для обнаружения геномных повреждений, вызванных событием дупликации или амплификации, CGH может быть выполнен с использованием мозаичного массива (array CGH ) или вариантная область может быть секвенирована. Длинные считывания секвенирования особенно полезны для анализа дупликаций или амплификаций, поскольку можно проанализировать ориентацию амплифицированных сегментов, если они были захвачены в одном считывании секвенирования.
Геномика рака или онкогеномика - это новая область, в которой применяется высокопроизводительная технология секвенирования ДНК второго поколения. последовательность полных геномов рака. Анализ этих данных секвенирования короткого чтения охватывает все проблемы, связанные со сборкой генома de novo с использованием данных короткого чтения. Кроме того, раковые геномы часто анеуплоидны. Эти аберрации, которые по существу являются крупномасштабными вариантами числа копий, могут быть проанализированы с помощью технологий секвенирования второго поколения, используя частоту считывания для оценки числа копий. Однако более длинные считывания дадут более точную картину количества копий, ориентации амплифицированных областей и SNP, присутствующих в геномах рака.
микробиом относится к общей коллекции микробов, присутствующих в микроокружении, и их соответствующих геномах. Например, около 100 триллионов микробных клеток колонизируют человеческое тело в любой момент времени. Микробиом человека представляет особый интерес, поскольку эти комменсальные бактерии важны для здоровья и иммунитета человека. Большинство бактериальных геномов Земли еще не секвенировано; осуществление проекта по секвенированию микробиома потребует обширной сборки генома de novo, что устрашает при использовании технологий короткого считывания ДНК. Более длинные чтения значительно упростят сборку новых микробных геномов.
По сравнению с другими технологиями секвенирования ДНК второго и третьего поколений секвенирование ДНК с помощью просвечивающей электронной микроскопии имеет ряд потенциальных основных сильных и слабых сторон, которые в конечном итоге определяют его полезность и известность как будущая технология секвенирования ДНК.
Многие технологии секвенирования ДНК второго и третьего поколений, не относящиеся к Сэнгеру, были разработаны или в настоящее время разрабатываются с общей целью увеличения пропускной способности и снижения стоимости, чтобы можно было полностью реализовать персонализированную генетическую медицину.
И присуждение 10 миллионов долларов США Archon X Prize в области геномики при поддержке X Prize Foundation (Санта-Моника, Калифорния, США) и грантов в размере 70 миллионов долларов США. при поддержке Национального исследовательского института генома человека Национальных институтов здравоохранения (NIH-NHGRI) способствуют быстрому росту исследовательской деятельности по разработке новых технологий секвенирования ДНК.
Поскольку каждую технологию секвенирования ДНК определяют разные подходы, методы и стратегии, у каждой из них есть свои сильные и слабые стороны. Сравнение важных параметров между различными технологиями секвенирования ДНК второго и третьего поколения представлено в таблице 1.
| Платформа | Поколение | Длина считывания (бит / с) | Точность | Стоимость одного генома человека (долл. США) | Стоимость прибора (долл. США) | Время выполнения (h / Gbp) |
|---|---|---|---|---|---|---|
| Массивно-параллельное пиросеквенирование путем синтеза | Второй | 400–500 | Длина чтения Q20 40 оснований (99% при 400 основаниях и выше для предшествующих оснований) | 1,000,000 | 500,000 | 75 |
| Секвенирование путем синтеза | Второй | 2 × 75 | Базовый вызов с Q30 (>70%) | 60,000 | 450,000 | 56 |
| Секвенирование на основе массового параллельного клонального лигирования на основе гранул | Второй | 100 | 99,94% | 60,000 | 591,000 | 42 |
| Массивно-параллельное секвенирование одной молекулы путем синтеза | Третий | 30–35 | 99,995% при>20-кратном охвате (необработанная частота ошибок: ≤ 5%) | 70,000 | 1,350,000 | ~ 12 |
| Отдельная молекула, секвенирование в реальном времени путем синтеза | Третья | 1000–1500 | 99,3% при 15-кратный охват (частота ошибок при однократном считывании: 15–20%) | – | – | <1 |
| Секвенирование нанопор | Третье | Потенциально неограниченное? | -- | -- | -- | >20 |
| Просвечивающая электронная микроскопия, однократная- секвенирование молекул (ZS Genetics, Halcyon Molecular) | Третий | Потенциально неограниченный? | -- | ~ 10,000 | ~ 1,000,000 | ~ 14 |