| серин-O-ацетилтрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
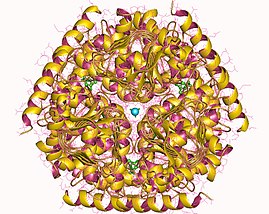 Гексамер серинацетилтрансферазы, Haemophilus influenzae Гексамер серинацетилтрансферазы, Haemophilus influenzae | |||||||||
| Идентификаторы | |||||||||
| Номер EC | 2.3.1.30 | ||||||||
| Номер CAS | 9023-16-9 | ||||||||
| Базы данных | |||||||||
| IntEnz | Представление IntEnz | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | Представление NiceZyme | ||||||||
| KEGG | Запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
В энзимология, серин-O-ацетилтрансфераза (EC 2.3.1.30 ) представляет собой фермент, который катализирует химическую реакцию
 КоА + O-ацетил - L -серин
КоА + O-ацетил - L -серинТаким образом, двумя субстратами этого фермента являются ацетил-КоА и L-серин, тогда как его два продуктами являются CoA и O-ацетил- L -серин.
Этот фермент принадлежит к семейству трансфераз, особенно те ацилтрансферазы, переносящие группы, отличные от аминоацильных групп. систематическое название этого класса ферментов - ацетил-КоА: L-серин-O-ацетилтрансфераза . Другие широко используемые названия включают САТаза, L-серинацетилтрансфераза, серинацетилтрансфераза и серинтрансацетилаза . Этот фермент участвует в метаболизме цистеина и метаболизме серы.
По состоянию на конец 2007 г. для этого класса ферментов было решено 7 структур с кодами доступа PDB 1S80, 1SSM, 1SSQ, 1SST, 1T3D, 1Y7L и 2ISQ.
| N-концевой домен SATase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
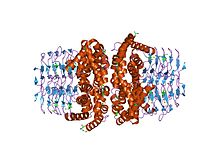 Структура фермента серинацетилтрансфераза-апофермент (усеченный) Структура фермента серинацетилтрансфераза-апофермент (усеченный) | |||||||||
| Идентификаторы | |||||||||
| Символ | SATase_N | ||||||||
| Pfam | PF06426 | ||||||||
| InterPro | IPR010493 | ||||||||
| |||||||||
В молекулярной биологии белковый домен SATase является сокращением от серинацетилтрансферазы и относится к фермент, который катализирует превращение L -серина в L-цистеин в E. coli. Более конкретно, его роль состоит в том, чтобы катализировать активацию L -серина ацетил-КоА. Эта запись относится к N-концу элемента белок, который имеет последовательность, которая консервативна в растениях и бактериях.
N -концевой домен белка серинацетилтрансферазы помогает катализировать перенос ацетила. Этот конкретный фермент катализирует серин в цистеин, который в конечном итоге превращается в незаменимую аминокислоту метионин. Особый интерес для ученых представляет способность использовать естественную способность фермента серинацетилтрансферазы создавать питательные незаменимые аминокислоты и использовать эту способность с помощью трансгенных растений. Эти трансгенные растения будут содержать больше незаменимых серных аминокислот, что означает более здоровую диету для людей и животных.
Аминоконцевой альфа-спиральный домен, в частности аминокислотные остатки His158 (гистидин в положении 158) и Asp143 (аспарагиновая кислота в положении 143) образуют каталитическую триаду с субстратом для ацетила перевод. Существует восемь альфа-спиралей, которые образуют N-концевой домен.
.