| Просмотр / редактирование Человека | Просмотр / редактирование мыши |
Дигидролипоилтрансацетилаза (или дигидролипоамидацетилтрансфераза) - это фермент компонент мультиферментного пируватдегидрогеназного комплекса. Комплекс пируватдегидрогеназы отвечает за этап декарбоксилирования пирувата, который связывает гликолиз с циклом лимонной кислоты. Это включает преобразование пирувата из гликолиза в ацетил-КоА, который затем используется в цикле лимонной кислоты для выполнения клеточного дыхания.
Существует три различных ферментных компонента в комплексе пируватдегидрогеназы. Пируватдегидрогеназа (EC 1.2.4.1) отвечает за окисление пирувата, дигидролипоилтрансацетилаза (этот фермент; EC 2.3.1.12) переносит ацетильную группу на кофермент A (CoA), и дигидролипоилдегидрогеназа (EC 1.8.1.4) регенерирует липоамид. Поскольку дигидролипоилтрансацетилаза является вторым из трех компонентов фермента, участвующих в механизме реакции превращения пирувата в ацетил-КоА, ее иногда называют E2.
У людей ферментативная активность дигидролипоилтрансацетилазы проявляется в компоненте комплекса пируватдегидрогеназы E2 (PDCE2), который кодируется DLAT (dигидро lипоамид S- aцетил tрансфераза) ген.
132>систематическое название этого класса ферментов - ацетил-КоА: фермент N6- (дигидролипоил) лизин-S-ацетилтрансфераза.
Другие широко используемые названия включают:
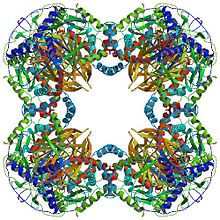 Кубическая каталитическая основная структура, состоящая из 24 субъединиц дигидролипоилтрансацетилазы.
Кубическая каталитическая основная структура, состоящая из 24 субъединиц дигидролипоилтрансацетилазы. 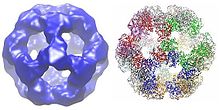 додекаэдрическая структура каталитического ядра, состоящая из 60 субъединиц дигидролипоилтрансацетилазы из Geobacillus stearothermophilus : трехмерная карта электронной микроскопии (слева) и структура дифракции рентгеновских лучей (справа).
додекаэдрическая структура каталитического ядра, состоящая из 60 субъединиц дигидролипоилтрансацетилазы из Geobacillus stearothermophilus : трехмерная карта электронной микроскопии (слева) и структура дифракции рентгеновских лучей (справа). Все дигидролипоилтрансацетилазы имеют уникальную многодоменную структуру, состоящую из (от N до C): 3 липоильных доменов, домена взаимодействия и каталитического домена (см. архитектуру домена в Pfam ). Все домены связаны неупорядоченными линкерными областями низкой сложности.
В зависимости от вида, несколько субъединиц ферментов дигидролипоилтрансацетилазы могут объединяться в кубическую или додекаэдрическую форму. Эти структуры затем образуют каталитическое ядро комплекса пируватдегидрогеназы, которое не только катализирует реакцию, которая переносит ацетильную группу на КоА, но также выполняет решающую структурную роль в создании архитектуры всего комплекса.
Кубическая структура ядра, обнаруженная у таких видов, как Azotobacter vinelandii, состоит всего из 24 субъединиц. Каталитические домены собраны в тримеры с активным центром, расположенным на границе раздела субъединиц. Топология активного сайта этого тримера идентична топологии хлорамфениколацетилтрансферазы. Затем восемь из этих тримеров складываются в полый усеченный куб. Два основных субстрата, КоА и липоамид (Lip (SH) 2), находятся у двух противоположных входов в канал длиной 30 Å, который проходит между субъединицами и образует каталитический центр. КоА поступает изнутри куба, а липоамид - снаружи.
У многих видов, включая бактерии, такие как Geobacillus stearothermophilus и Enterococcus faecalis, а также у млекопитающих, таких как люди и коровы, додекаэдрическая структура ядра состоит всего из 60 субъединиц. Субъединицы расположены в наборах по три, аналогично тримерам в форме кубического ядра, причем каждый набор составляет одну из 20 додекаэдрических вершин.
| ацетилтрансфераза дигидролипоиллизинового остатка | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.1.12 | ||||||||
| Номер CAS | 9032-29-5 | ||||||||
| Базы данных | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
Дигидролипоилтрансацетилаза участвует в реакции декарбоксилирования пирувата, которая связывает гликолиз с циклом лимонной кислоты. Эти метаболические процессы важны для клеточного дыхания - преобразования биохимической энергии из питательных веществ в аденозинтрифосфат (АТФ), который затем может использоваться для проведения многочисленных биологических реакций внутри клетки. Различные части клеточного дыхания происходят в разных частях клетки. У эукариот гликолиз происходит в цитоплазме, декарбоксилирование пирувата в митохондриях, цикл лимонной кислоты в митохондриальном матриксе и окислительное фосфорилирование через цепь переноса электронов в митохондриях кристы. Таким образом, пируватдегидрогеназные комплексы (содержащие ферменты дигидролипоилтрансацетилазы) обнаруживаются в митохондриях эукариот (и просто в цитозоле прокариот).
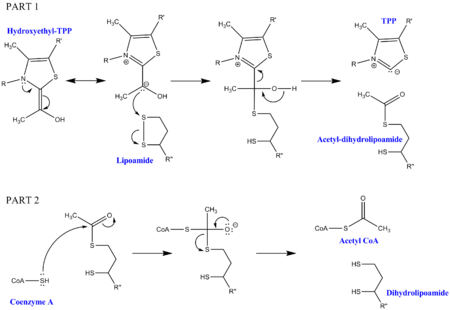 Механизм дигидролипоилтрансацетилазы
Механизм дигидролипоилтрансацетилазы Декарбоксилирование пирувата требует нескольких кофакторов в дополнение к ферментам, составляющим комплекс. Первый - это тиаминпирофосфат (TPP), который используется пируватдегидрогеназой для окисления пирувата и образования промежуточного продукта гидроксиэтил-TPP. Этот промежуточный продукт поглощается дигидролипоилтрансацетилазой и реагирует со вторым липоамидным кофактором с образованием промежуточного ацетил-дигидролипоила, высвобождая TPP в процессе. Этот второй промежуточный продукт затем может быть атакован нуклеофильной серой, присоединенной к коферменту А, и высвобождается дигидролипоамид. Это приводит к образованию ацетил-КоА, что является конечной целью декарбоксилирования пирувата. Дигидролипоамид поглощается дигидролипоилдегидрогеназой, а с дополнительными кофакторами FAD и NAD + регенерирует исходный липоамид (с NADH в качестве полезного побочного продукта).
Нажмите на гены, белки и метаболиты ниже, чтобы сделать ссылку на соответствующие статьи.
[[File: [[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]]
[[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]][[]] | {{{bSize}}} px | alt = Гликолиз и Глюконеогенез редактировать ]] Гликолиз и глюконеогенез редактировать
| {{{bSize}}} px | alt = Гликолиз и Глюконеогенез редактировать ]] Гликолиз и глюконеогенез редактировать Первичный билиарный цирроз (ПБЦ) является аутоиммунным заболеванием характеризуется аутоантителами против митохондриальных и ядерных антигенов. Они называются антимитохондриальными антителами (AMA) и антиядерными антителами (ANA) соответственно. Эти антитела обнаруживаются в сыворотке пациентов с ПБЦ и сильно различаются в отношении специфичности эпитопа от пациента к пациенту. Из митохондриальных антигенов, которые могут вызывать реактивность аутоантител у пациентов с ПБЦ, субъединица E2 пируватдегидрогеназного комплекса, дигидролипоилтрансацетилаза, является наиболее распространенным эпитопом (другие антигены включают ферменты комплексов 2-оксокислоты дегидрогеназы, а также другие ферменты пируватдегидрогеназные комплексы). Недавние данные показали, что пептиды в каталитическом сайте могут представлять иммунодоминантные эпитопы, распознаваемые антителами против PDC-E2 у пациентов с ПБЦ. Также имеются доказательства наличия антител против PDC-E2 у пациентов с аутоиммунным гепатитом (AIH).
Дефицит пируватдегидрогеназы (PDH) является генетическим заболеванием приводящие к лактоацидозу, а также к неврологической дисфункции в младенчестве и раннем детстве. Обычно ПДГ является результатом мутации Х-сцепленного гена для субъединицы E1 пируватдегидрогеназного комплекса. Однако было несколько редких случаев, когда у пациента с ПДГ действительно была мутация в аутосомном гене для субъединицы E2. Сообщалось, что у этих пациентов были гораздо менее тяжелые симптомы, причем наиболее ярким проявлением заболевания была эпизодическая дистония, хотя присутствовали и гипотония, и атаксия.