 Химическая структура кардиолипина
Химическая структура кардиолипина Кардиолипин (название IUPAC 1,3-бис (sn-3'- фосфатидил) -sn-глицерин, также известный как калькуттский антиген ), является важным компонентом внутренней митохондриальной мембраны, где он составляет около 20% от общего липидного состава. Его также можно найти в мембранах большинства бактерий. Название «кардиолипин» произошло от того факта, что он был впервые обнаружен в сердцах животных. Впервые он был выделен из говяжьего сердца в начале 1940-х годов. В клетках млекопитающих, но также и в клетках растений, кардиолипин (CL) обнаруживается почти исключительно во внутренней митохондриальной мембране, где он необходим для оптимальной функции многочисленных ферментов, участвующих в метаболизме энергии митохондрий.
 Кардиолипин в тканях животных
Кардиолипин в тканях животных Кардиолипин (CL) представляет собой разновидность липида дифосфатидилглицерина. Две части фосфатидной кислоты соединяются с основной цепью глицерина в центре с образованием димерной структуры. Таким образом, он имеет четыре алкильные группы и потенциально несет два отрицательных заряда. Так как кардиолипин состоит из четырех различных алкильных цепей, потенциал сложности этого вида молекул огромен. Однако в большинстве тканей животных кардиолипин содержит 18-углеродные жирные алкильные цепи с 2 ненасыщенными связями на каждой из них. Было высказано предположение, что конфигурация (18: 2) 4 ацильной цепи является важным структурным требованием для высокого сродства CL к белкам внутренней мембраны в митохондриях млекопитающих. Однако исследования с изолированными ферментными препаратами показывают, что его важность может варьироваться в зависимости от исследуемого белка.
Поскольку в молекуле два фосфата, каждый из них может улавливать один протон. Хотя он имеет симметричную структуру, ионизация одного фосфата происходит при очень разных уровнях кислотности, чем ионизация обоих: pK 1 = 3 и pK 2>7,5. Таким образом, в нормальных физиологических условиях (при pH около 7) молекула может нести только один отрицательный заряд. Гидроксильные группы (–OH и –O) на фосфате будут образовывать стабильную внутримолекулярную водородную связь с гидроксильной группой центрированного глицерина, образуя, таким образом, бициклическую резонансную структуру. Эта структура захватывает один протон, что очень полезно для окислительного фосфорилирования.
. Поскольку головная группа образует такую компактную велосипедную структуру, площадь головной группы довольно мала по сравнению с большой хвостовой областью, состоящей из 4 ацильных цепей. На основе этой особой структуры в 1982 году был введен флуоресцентный митохондриальный индикатор нонилакридиновый оранжевый (NAO), который, как позже было обнаружено, воздействует на митохондрии путем связывания с CL. У NAO очень большая голова и маленькая структура хвоста, которая может компенсировать маленькую голову кардиолипина, большую структуру хвоста, и располагаться строго упорядоченным образом. Было опубликовано несколько исследований с использованием NAO как количественного митохондриального индикатора, так и индикатора содержания ХЛ в митохондриях. Однако на NAO влияет мембранный потенциал и / или пространственное расположение CL, поэтому нецелесообразно использовать NAO для количественных исследований CL или митохондрий интактных дышащих митохондрий. Но NAO по-прежнему представляет собой простой метод оценки содержания CL.
Бициклическая структура кардиолипина

Структура NAO
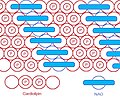
NAO и CL организована высокоупорядоченным образом
 Синтез кардиолипина у эукариот
Синтез кардиолипина у эукариот Считается, что у эукариот, таких как дрожжи, растения и животные, процессы синтеза происходят в митохондриях. Первым этапом является ацилирование глицерин-3-фосфата глицерин-3-фосфат ацилтрансферазой. Затем ацилглицерин-3-фосфат можно еще раз ацилировать с образованием фосфатидной кислоты (PA). С помощью фермента ЦДФ-ДАГ-синтаза (CDS) (фосфатидатцитидилилтрансфераза ) PA превращается в цитидиндифосфат -диацилглицерин (CDP-DAG). Следующим этапом является преобразование CDP-DAG в фосфатидилглицерин фосфат (PGP) ферментом PGP-синтазой с последующим дефосфорилированием PTPMT1 с образованием PG. Наконец, молекула CDP-DAG связывается с PG с образованием одной молекулы кардиолипина, катализируемой локализованным в митохондриях ферментом кардиолипинсинтазой (CLS).
В прокариотах, таких как В бактериях дифосфатидилглицеринсинтаза катализирует перенос фосфатидил фрагмента одного фосфатидилглицерина на свободную 3'-гидроксильную группу другого с отщеплением одной молекулы глицерина за счет действия фермента, относящегося к фосфолипаза D. В некоторых физиологических условиях фермент может действовать в обратном порядке, удаляя кардиолипин.
Катаболизм кардиолипина может происходить при катализе фосфолипазы A2 (PLA) для удаления жирных ацильных групп. Фосфолипаза D (PLD) в митохондриях гидролизует кардиолипин до фосфатидной кислоты.
 Перенос электронов через дыхательные пути Комплекса IV
Перенос электронов через дыхательные пути Комплекса IV Из-за действия кардиолипина уникальная структура, изменение pH и присутствие двухвалентных катионов могут вызвать структурные изменения. CL показывает большое разнообразие форм агрегатов. Обнаружено, что в присутствии Са или других двухвалентных катионов CL может иметь фазовый переход пластинчатый -в гексагональный (La-HII). И считается, что он имеет тесную связь с слиянием мембран.
Фермент цитохром с оксидаза, также известный как Комплекс IV, является большим комплекс трансмембранного белка, обнаруженный в митохондриях и бактериях. Это последний фермент в дыхательной цепи переноса электронов, расположенный во внутренней митохондриальной или бактериальной мембране. Он получает электрон от каждой из четырех молекул цитохрома с и передает их одной молекуле кислорода, превращая молекулярный кислород в две молекулы воды. Было показано, что Комплексу IV необходимы две связанные молекулы CL для поддержания его полной ферментативной функции. Цитохром bc1 (Комплекс III) также нуждается в кардиолипине для поддержания своей четвертичной структуры и функциональной роли. Комплекс V механизма окислительного фосфорилирования также демонстрирует высокую аффинность связывания с CL, связывая четыре молекулы CL на молекулу комплекса V.
 Механизм, посредством которого CL запускает апоптоз
Механизм, посредством которого CL запускает апоптоз Распределение кардиолипина на внешней митохондриальной мембране должно приводить к апоптозу клеток, о чем свидетельствует высвобождение цитохрома c (cyt c), активация каспазы-8, индукция MOMP и активация инфламмасомы NLRP3. Во время апоптоза cyt c высвобождается из межмембранного пространства митохондрий в цитозоль. Cyt c может затем связываться с рецептором IP3 на эндоплазматическом ретикулуме, стимулируя высвобождение кальция, который затем реагирует обратно, вызывая высвобождение cyt c. Когда концентрация кальция достигает токсичного уровня, это вызывает гибель клеток. Считается, что цитохром c играет роль в апоптозе посредством высвобождения апоптотических факторов из митохондрий. Кардиолипин-специфическая оксигеназа продуцирует CL гидропероксиды, которые могут приводить к изменению конформации липида. Окисленный CL переносится с внутренней мембраны на внешнюю, а затем помогает формировать проницаемую пору, которая высвобождает cyt c.
 CL служит ловушкой протонов при окислительном фосфорилировании
CL служит ловушкой протонов при окислительном фосфорилировании Во время процесса окислительного фосфорилирования, катализируемого Комплексом IV, большое количество протонов переносится с одной стороны мембраны на другую, вызывая большое изменение pH. Предполагается, что CL действует как ловушка для протонов внутри митохондриальных мембран, тем самым строго локализуя пул протонов и минимизируя изменения pH в межмембранном пространстве митохондрий.
Эта функция обусловлена уникальной структурой CL. Как указано выше, CL может захватывать протон в бициклической структуре, неся отрицательный заряд. Таким образом, эта бициклическая структура может служить в качестве электронного буферного пула для высвобождения или поглощения протонов для поддержания pH около мембран.
Синдром Барта - редкое генетическое заболевание, которое в 1970-х годах было признано причиной детской смерти. Он имеет мутацию в гене, кодирующем тафаззин, фермент, участвующий в биосинтезе кардиолипина. Тафаззин - незаменимый фермент для синтеза кардиолипина у эукариот, участвующих в ремоделировании ацильных цепей CL путем переноса линолевой кислоты от ПК к монолизокардиолипину. Мутация тафаззина вызывает недостаточное ремоделирование кардиолипина. Тем не менее, похоже, что клетки компенсируют, и производство АТФ аналогично или выше, чем у нормальных клеток. Самки гетерозиготные по этому признаку не затронуты. У людей, страдающих этим заболеванием, аномальные митохондрии. Кардиомиопатия и общая слабость часто встречаются у этих пациентов.
Окислительный стресс и перекисное окисление липидов считаются факторами, ведущими к потере нейронов и дисфункции митохондрий в черной субстанции при болезни Паркинсона. заболевание, и может играть раннюю роль в патогенезе болезни Альцгеймера. Сообщается, что содержание ХЛ в головном мозге снижается с возрастом, и недавнее исследование мозга крыс показывает, что это является результатом перекисного окисления липидов в митохондриях, подвергшихся воздействию свободных радикалов. Другое исследование показывает, что путь биосинтеза ХЛ может быть выборочно нарушен, вызывая снижение на 20% и изменение состава содержания ХЛ. Это также связано со снижением на 15% активности связанного комплекса I / III в цепи переноса электронов, что считается критическим фактором в развитии болезни Паркинсона.
Недавно сообщалось, что при неалкогольной жировой болезни печени и сердечной недостаточности снижение уровня ХЛ и изменение состава ацильной цепи также наблюдаются в митохондриях. дисфункция. Тем не менее, роль CL в процессе старения и ишемии / реперфузии остается спорным.
Болезнь Танжера также связана с аномалиями ХЛ. Болезнь Танжера характеризуется очень низким уровнем в плазме крови холестерина липопротеинов высокой плотности (ЛПВП) («хороший холестерин»), накоплением сложных эфиров холестерина в тканях и повышенным риском развивающееся сердечно-сосудистое заболевание. В отличие от синдрома Барта, болезнь Танжера в основном вызывается аномально повышенной выработкой CL. Исследования показывают, что при болезни Танжера уровень ХЛ увеличивается в три-пять раз. Поскольку повышенные уровни CL усиливают окисление холестерина, а затем образование оксистеринов, следовательно, увеличивает отток холестерина. Этот процесс может функционировать как механизм ускользания от избытка холестерина из клетки.
Болезни сердца в два раза чаще встречаются у людей с диабетом. У диабетиков сердечно-сосудистые осложнения возникают в более раннем возрасте и часто приводят к преждевременной смерти, что делает сердечные заболевания главным убийцей диабетиков. Было обнаружено, что кардиолипин дефицит в сердце на самых ранних стадиях диабета, возможно, из-за фермента, переваривающего липиды, который становится более активным в диабетической сердечной мышце.
Кардиолипин из коровье сердце используется в качестве антигена в тесте Вассермана на сифилис. Антитела к кардиолипину также могут быть увеличены при многих других состояниях, включая системную красную волчанку, малярию и туберкулез, поэтому этот тест не является специфичным.
Вирус иммунодефицита человека -1 (ВИЧ-1) заразил более 60 миллионов человек во всем мире. Гликопротеин оболочки ВИЧ-1 содержит по крайней мере четыре сайта для нейтрализующих антител. Среди этих сайтов (MPR) особенно привлекателен в качестве мишени для антител, поскольку он способствует проникновению вируса в Т-клетки и является высококонсервативным среди вирусных штаммов. Однако обнаружено, что два антитела, направленные против 2F5, 4E10 в MPR, реагируют с аутоантигенами, включая кардиолипин. Таким образом, такие антитела трудно вызвать вакцинацией.
Впервые Отто Генрих Варбург предположил, что рак возник в результате необратимого повреждения митохондриального дыхания, но структурная основа этой травмы так и осталась неуловимой. Поскольку кардиолипин является важным фосфолипидом, который обнаруживается почти исключительно во внутренней митохондриальной мембране и очень важен для поддержания функции митохондрий, предполагается, что аномалии ХЛ могут нарушать функцию митохондрий и биоэнергетику. Исследование опухолей головного мозга мышей, опубликованное в 2008 году в поддержку теории рака Варбурга, показывает серьезные отклонения в содержании или составе ХЛ во всех опухолях.
Пациенты с антикардиолипиновыми антителами (Антифосфолипидный синдром ) могут иметь рецидивирующие тромботические события даже на ранней стадии в середине или в конце жизни. подростковые годы. Эти события могут происходить в сосудах, в которых тромбоз может быть относительно редко, например, в печеночных или почечных венах. Эти антитела обычно обнаруживаются у молодых женщин с повторяющимися самопроизвольными абортами. При аутоиммунном заболевании, опосредованном антикардиолипином, распознавание зависит от аполипопротеина H.
Бартонеллез - это серьезная хроническая бактериальная инфекция, которой обладают как кошки, так и люди. Спинелла обнаружила, что у одного пациента с bartonella henselae также были антитела к кардиолипину, что позволяет предположить, что бартонелла может вызвать их выработку.
Синдром хронической усталости - изнурительное заболевание неизвестной причины, которое часто следует острая вирусная инфекция. Согласно одному исследованию, 95% пациентов с CFS имеют антитела к кардиолипину.