| Тимидинкиназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллическая структура тетрамера тимидинкиназы из U. urealyticum (где мономеры имеют цвет голубой, зеленый, красный и пурпурный соответственно) в комплексе с тимидином (модель заполнения пространства, углерод = белый, кислород = красный, азот = синий). Кристаллическая структура тетрамера тимидинкиназы из U. urealyticum (где мономеры имеют цвет голубой, зеленый, красный и пурпурный соответственно) в комплексе с тимидином (модель заполнения пространства, углерод = белый, кислород = красный, азот = синий). | |||||||||
| Идентификаторы | |||||||||
| Номер EC | 2.7.1.21 | ||||||||
| Номер CAS | 9002-06-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
| тимидинкиназа | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| идентификаторы | |||||||||||
| символ | TK | ||||||||||
| Pfam | PF00265 | ||||||||||
| Pfam клан | CL0023 | ||||||||||
| InterPro | IPR001267 | ||||||||||
| PROSITE | PDOC00524 | ||||||||||
| |||||||||||
| Тимидинкиназа 1, растворимая | |
|---|---|
| Идентификаторы | |
| Символ | TK1 |
| Ген NCBI | 7083 |
| HGNC | 11830 |
| OMIM | 188300 |
| RefSeq | NM_003258 |
| UniProt | P04183 |
| Прочие данные | |
| Номер EC | 2.7.1.21 |
| Locus | Chr. 17 q23.2-25.3 |
| Тимидинкиназа 2, митохондриальная | |
|---|---|
| Идентификаторы | |
| Символ | TK2 |
| Ген NCBI | 7084 |
| HGNC | 11831 |
| OMIM | 188250 |
| RefSeq | NM_004614 |
| UniProt | O00142 |
| Прочие данные | |
| Номер ЕС | 2.7.1.21 |
| Locus | Chr. 16 [1] |
Тимидинкиназа - это фермент, фосфотрансфераза (киназа): 2'-дезокситимидинкиназа, АТФ-тимидин 5'-фосфотрансфераза, EC 2.7.1.21. Его можно найти в большинстве живых клеток. Он присутствует в клетках млекопитающих в двух формах, TK1 и TK2. Некоторые вирусы также обладают генетической информацией для экспрессии вирусных тимидинкиназ. Тимидинкиназа катализирует реакцию:
где Thd представляет собой (дезокси) тимидин, ATP представляет собой аденозинтрифосфат, TMP представляет собой (дезокси) тимидинмонофосфат и АДФ представляет собой аденозиндифосфат. Тимидинкиназы выполняют ключевую функцию в синтезе ДНК и, следовательно, в делении клетки, поскольку они являются частью уникальной цепочки реакций по введению тимидина в ДНК. Тимидин присутствует в жидкостях организма в результате деградации ДНК из пищи и мертвых клеток. Тимидинкиназа необходима для действия многих противовирусных препаратов. Он используется для отбора клеточных линий гибридомы для получения моноклональных антител. В клинической химии он используется как маркер пролиферации в диагнозе, контроле лечения и последующем наблюдении злокачественного заболевания, в основном из гематологических злокачественных новообразований.
Включение тимидина в ДНК было продемонстрировано примерно в 1950 году. Несколько позже было показано, что этому включению предшествовало фосфорилирование, и примерно в 1960 году ответственный фермент был очищен.
Были идентифицированы два разных класса тимидинкиназ, которые включены в это суперсемейство: одно семейство объединяет тимидинкиназы из вируса герпеса, а также клеточные тимидилаткиназы, второе семейство группирует ТЗ из различных источников, включая позвоночные, бактерии, бактериофаг T4, поксвирусы, вирус африканской чумы свиней (ASFV) и вирус болезни рыб лимфоцистоза (FLDV). Основной белок капсида радужных вирусов насекомых также принадлежит к этому семейству. Паттерн Prosite распознает только клеточный тип тимидинкиназ.
У млекопитающих есть два изофермента, которые сильно различаются по химическому составу, TK1 и TK2. Первый был впервые обнаружен в тканях плода, второй был обнаружен в большей степени в тканях взрослого человека, и первоначально они были названы тимидинкиназой плода и взрослого. Вскоре было показано, что TK1 присутствует в цитоплазме только в ожидании клеточного деления (зависит от клеточного цикла), тогда как TK2 находится в митохондриях и не зависит от клеточного цикла. Два изофермента имеют разную кинетику реакции и ингибируются разными ингибиторами.
Вирусные тимидинкиназы полностью отличаются от ферментов млекопитающих как структурно, так и биохимически и ингибируются ингибиторами, которые не ингибируют ферменты млекопитающих. Гены двух изоферментов человека были локализованы в середине 1970-х годов. Ген TK1 был клонирован и секвенирован. Соответствующий белок имеет молекулярную массу примерно 25 кДа. Обычно он встречается в ткани в виде димера с молекулярной массой около 50 кДа. Может быть активирован АТФ. После активации представляет собой тетрамер с молекулярной массой около 100 кДа. Однако форма фермента, присутствующего в кровотоке, не соответствует белку, который кодируется геном: основная фракция активного фермента в кровотоке имеет молекулярную массу 730 кДа и, вероятно, связана в комплексе с другими белками. Этот комплекс более стабилен и имеет более высокую удельную активность, чем любая из форм с более низкой молекулярной массой.
Рекомбинантный TK1 не может быть активирован и преобразован в тетрамер таким образом, что свидетельствует о том, что фермент, присутствующий в клетках, был модифицирован после синтеза.
TK1 синтезируется клеткой во время S-фазы клеточного деления. После завершения деления клеток TK1 разрушается внутриклеточно и не переходит в жидкости организма после нормального деления клеток. Существует обратная регуляция действия тимидинкиназы в клетке: тимидинтрифосфат (ТТФ), продукт дальнейшего фосфорилирования тимидина, действует как ингибитор тимидина. киназа. Это служит для поддержания сбалансированного количества ТТФ, доступного для синтеза нуклеиновых кислот, не перенасыщая систему. 5'-Аминотимидин, нетоксичный аналог тимидина, нарушает этот регуляторный механизм и тем самым увеличивает цитотоксичность аналогов тимидина, используемых в качестве противоопухолевых препаратов. Кинетика реакции фосфорилирования тимидина и аналогов тимидина сложна и известна лишь частично. Общее фосфорилирование тимидина до тимидинтрифосфата не следует кинетике Михаэлиса-Ментен, а различные фосфаты тимидина и уридина мешают фосфорилированию друг друга. Кинетика TK от разных видов отличается друг от друга, а также разные формы от данного вида (мономер, димер, тетрамер и форма сыворотки) имеют разные кинетические характеристики.
Гены вирус-специфичных тимидинкиназ были идентифицированы в вирусе простого герпеса, вирусе ветряной оспы и вирусе Эпштейна-Барра.
 + АТФ --->
+ АТФ ---> + АДФ
+ АДФ
Тимидин реагирует с АТФ с образованием тимидинмонофосфата и АДФ.
Тимидинмонофосфат, продукт реакции, катализируемой тимидинкиназой, в свою очередь фосфорилируется до тимидиндифосфата ферментом тимидилаткиназой и далее к тимидинтрифосфату ферментом нуклеозиддифосфаткиназой. Трифосфат включен в молекулу ДНК, реакцию, катализируемую ДНК-полимеразой и комплементарной молекулой ДНК (или молекулой РНК в случае обратной транскриптазы, ферментом, присутствующим в ретровирус ).
Монофосфат тимидина также продуцируется клеткой в другой реакции путем метилирования дезоксиуридинмонофосфата, продукта других метаболических путей, не связанных с тимидином, ферментом тимидилатсинтаза. Второго пути достаточно для доставки тимидинмонофосфата для репарации ДНК. Когда клетка готовится к делению, требуется совершенно новая структура ДНК, и потребность в строительных блоках, включая тимидинтрифосфат, возрастает. Клетки готовятся к делению, вырабатывая некоторые ферменты, необходимые во время деления. Обычно они не присутствуют в ячейках и впоследствии подавляются и ухудшаются. Такие ферменты называются вспомогательными ферментами. Тимидинкиназа 1 является таким спасательным ферментом, тогда как тимидинкиназа 2 и тимидилатсинтаза не зависят от клеточного цикла.
Тимидинкиназа 2 используется клетками для синтеза митохондриальной ДНК. Мутации в гене TK2 приводят к миопатической форме синдрома истощения митохондриальной ДНК. Другой причиной дефицита TK2 может быть вызванное окислительным стрессом S-глутатионилирование и протеолитическая деградация митохондриальной тимидинкиназы 2. Синдром, вызванный дефицитом TK1, не известен, вероятно, поскольку дефектный ген TK1 может привести к гибели плода.
Образование тетрамера после модификации тимидинкиназы 1 после синтеза увеличивает активность фермента. Было высказано предположение, что это механизм регуляции активности фермента. Образование тетрамеров наблюдается после стадии развития Dictyostelium. Предполагается, что его использование для тонкой регуляции синтеза ДНК было установлено у теплокровных животных после того, как они отделились от позвоночных. Также изучалось развитие тимидинкиназоподобных ферментов в процессе развития.
Тимидинкиназа присутствует у животных, растений, некоторых бактерий, архей и вирусов.. Были идентифицированы и в различной степени охарактеризованы тимидинкиназы из вирусов оспы, вируса африканской чумы свиней, вируса простого герпеса, вируса ветряной оспы и вируса Эпштейна-Барра. Форма фермента у вируса отличается от формы у других организмов. Тимидинкиназа не присутствует в грибах.
Первым непрямым применением тимидинкиназы в биохимических исследованиях была идентификация делящихся клеток путем включения радиоактивно меченых тимидин и последующее измерение радиоактивности или авторадиография для идентификации делящихся клеток. Для этого в среду для выращивания добавляют меченный тритием тимидин. Несмотря на ошибки в методике, он все еще используется для определения скорости роста злокачественных клеток и для изучения активации лимфоцитов в иммунологии.
Фтортимидин является аналогом тимидина . Его захват регулируется тимидинкиназой 1, и поэтому он преимущественно поглощается быстро пролиферирующей опухолевой тканью. Изотоп 18 фтора представляет собой эмиттер позитронов, который используется в позитронно-эмиссионной томографии (ПЭТ). Радиоактивно меченный фтором-18 фтортимидин F-18 поэтому полезен для ПЭТ-визуализации активной пролиферации опухоли и выгодно отличается от более часто используемого маркера флудезоксиглюкозы (18F). Был предложен стандартизированный протокол, который поможет в сравнении клинических исследований.
Гибридомы - это клетки, полученные путем слияния опухолевых клеток (которые могут делиться бесконечно) и продуцирующих иммуноглобулин лимфоциты (плазматические клетки). Гибридомы можно увеличивать для производства большого количества иммуноглобулинов с заданной уникальной специфичностью (моноклональные антитела). Одна из проблем состоит в том, чтобы выделить гибридомы из большого избытка неслитых клеток после слияния клеток. Одним из распространенных способов решения этой проблемы является использование тимидинкиназотрицательных (TK-) опухолевых линий клеток для слияния. Клетки, отрицательные по тимидинкиназе, получают путем выращивания линии опухолевых клеток в присутствии аналогов тимидина, которые убивают клетки, положительные по тимидинкиназе (TK +). Затем отрицательные клетки можно размножить и использовать для слияния с плазматическими клетками TK +. После слияния клетки выращивают в среде с метотрексатом или аминоптерином, которые ингибируют фермент дигидрофолатредуктазу, тем самым блокируя синтез тимидинмонофосфата de novo. Одна из таких обычно используемых сред - это среда HAT, которая содержит гипоксантин, аминоптерин и тимидин. Неслитые клетки из линии клеток с дефицитом тимидинкиназы погибают, потому что они не имеют источника тимидинмонофосфата. Лимфоциты в конечном итоге умирают, потому что они не «бессмертны». Выживают только гибридомы, которые имеют «бессмертие» от своей клеточной линии-предка и тимидинкиназу от плазматической клетки. Затем отбирают те, которые продуцируют желаемое антитело, и культивируют для получения моноклонального антитела. Гибридомные клетки также могут быть выделены с использованием того же принципа, который описан в отношении другого гена, HGPRT, который синтезирует IMP, необходимый для синтеза нуклеотидов GMP в пути восстановления.
Молекулярное расчесывание волокон ДНК можно использовать для отслеживания структуры хромосом у почкующихся дрожжей Saccharomyces cerevisiae. Это обеспечивает профили репликации ДНК отдельных молекул. Для этого необходимо, чтобы штаммы дрожжей экспрессировали тимидинкиназу, чего дрожжи дикого типа не экспрессируют, будучи грибами (см. «Вхождение»). Следовательно, ген тимидинкиназы должен быть включен в геном.
Тимидинкиназа - это спасательный фермент, который присутствует только в ожидании деления клеток. Фермент не высвобождается из клеток, подвергающихся нормальному делению, где у клеток есть специальный механизм для разрушения белков, которые больше не нужны после деления клетки. Таким образом, у здоровых людей количество тимидинкиназы в сыворотке или плазме очень низкое. Опухолевые клетки выделяют фермент в кровоток, вероятно, в связи с разрушением мертвых или умирающих опухолевых клеток. Таким образом, уровень тимидинкиназы в сыворотке крови служит мерой злокачественной пролиферации, а косвенно - мерой агрессивности опухоли.
Некоторые лекарственные препараты специально направлены против делящихся клеток. Их можно использовать против опухолей и вирусных заболеваний (как против ретровирусов, так и против других вирусов), поскольку больные клетки реплицируются намного чаще, чем нормальные клетки, а также против некоторых незлокачественных заболеваний, связанных с чрезмерно быстрой репликацией клеток (например, псориаза). Было высказано предположение, что противовирусная и противораковая активность аналогов тимидина, по крайней мере частично, достигается за счет подавления митохондриальной тимидинкиназы.
Существуют разные классы препаратов направлено против метаболизма тимидина и, таким образом, включает тимидинкиназу, которая используется для контроля деления клеток, связанных с раком. Терминаторы цепи представляют собой аналоги тимидина, которые включены в растущую цепь ДНК, но модифицированы таким образом, чтобы цепь не удлинялась в дальнейшем. Как аналоги тимидина, препараты этого типа легко фосфорилируются до 5'-монофосфатов. Монофосфат далее фосфорилируется до соответствующего трифосфата и включается в растущую цепь ДНК. Аналог был модифицирован так, что он не имеет гидроксильной группы в 3'-положении, которое требуется для продолжения роста цепи. В зидовудине (AZT; ATC: J05AF01) 3'-гидроксильная группа заменена азидогруппой, в ставудине (ATC: J05AF04) она удалена без замены. AZT используется в качестве субстрата в одном из методов определения тимидинкиназы в сыворотке крови. Это означает, что АЗТ мешает этому методу и может быть ограничением: АЗТ является стандартным компонентом терапии ВААРТ при ВИЧ-инфекции. Одним из частых последствий СПИДа является лимфома, и наиболее важным диагностическим применением определения тимидинкиназы является мониторинг лимфомы.

AZT

Ставудин

Идоксуридин

Ацикловир
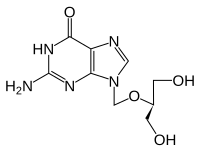
Ганцикловир
Другие аналоги тимидина, например идоксуридин (ATC: J05AB02), действуют следующим образом: блокирование спаривания оснований во время последующих циклов репликации, тем самым делая полученную цепь ДНК дефектной. Это также может сочетаться с радиоактивностью для достижения апоптоза злокачественных клеток.
Некоторые противовирусные препараты, такие как ацикловир (ATC: J05AB01) и ганцикловир (ATC: J05AB06), а также другие аналоги нуклеозидов используют субстратную специфичность вирусной тимидинкиназы в отличие от тимидинкиназ человека. Эти препараты действуют как пролекарства, которые сами по себе не токсичны, но превращаются в токсичные препараты путем фосфорилирования вирусной тимидинкиназой. Поэтому клетки, инфицированные вирусом, производят высокотоксичные трифосфаты, которые приводят к гибели клеток. Человеческая тимидинкиназа, напротив, с ее более узкой специфичностью неспособна фосфорилировать и активировать пролекарство. Таким образом, к препарату чувствительны только клетки, инфицированные вирусом. Такие препараты эффективны только против вирусов из группы герпеса с их специфической тимидинкиназой. У пациентов, принимающих этот тип препаратов, часто наблюдается развитие устойчивости к противовирусным препаратам. Секвенирование гена тимидинкиназы в вирусе простого герпеса и вирусе ветряной оспы показывает быструю генетическую изменчивость и может облегчить диагностику устойчивости к противовирусным препаратам.
После того, как в декабре 1979 года ВОЗ объявила о ликвидации оспы, программы вакцинации были прекращены. Повторное появление болезни либо случайно, либо в результате биологической войны затронет незащищенное население и может привести к эпидемии, которую трудно будет контролировать. Массовая вакцинация для борьбы с эпидемией оспы может оказаться сложной задачей, поскольку единственная одобренная вакцина против оспы, вирус осповакцины, может иметь серьезные побочные эффекты. Тем не менее, некоторые правительства создают запасы вакцины против оспы, чтобы застраховаться от такой возможности. Однако приоритетной задачей является разработка конкретных и эффективных противовирусных препаратов. Одним из возможных подходов было бы использование для этой цели специфичности тимидинкиназы поксвируса, аналогично тому, как она используется для лекарств против вируса герпеса. Одна из трудностей состоит в том, что тимидинкиназа поксвируса принадлежит к тому же семейству тимидинкиназ, что и тимидинкиназы человека, и, следовательно, более похожа химически. Таким образом, структура тимидинкиназ поксвируса была определена для поиска потенциальных противовирусных препаратов. Однако поиски еще не привели к пригодному для использования противовирусному препарату против поксвирусов.
Ген тимидинкиназы герпесвируса также использовался в качестве «суицидного гена» в качестве системы безопасности в экспериментах по генной терапии, позволяя клеткам экспрессировать ген быть убитым с помощью ганцикловира. Это желательно в случае, если рекомбинантный ген вызывает мутацию, приводящую к неконтролируемому росту клеток (инсерционный мутагенез). Цитотоксические продукты, продуцируемые этими модифицированными клетками, могут диффундировать к соседним клеткам, делая их одинаково восприимчивыми к ганцикловиру, явление, известное как «эффект свидетеля». Этот подход использовался для лечения рака на животных моделях, и его преимущество заключается в том, что опухоль может быть уничтожена всего лишь с помощью 10% злокачественных клеток, экспрессирующих ген. Подобная система была опробована с использованием тимидинкиназы томатов и AZT. Кроме того, ген тимидинкиназы используется в качестве гена самоубийства для борьбы с опасной реакцией трансплантат против хозяина в терапии трансплантации гемопоэтических стволовых клеток под названием Zalmoxis, которая была условно одобрена в Европе в 2016 году
Аналогичное использование тимидинкиназы использует присутствие в некоторых опухолевых клетках веществ, не присутствующих в нормальных клетках (опухолевые маркеры ). Такими опухолевыми маркерами являются, например, CEA (карциноэмбриональный антиген) и AFP (альфа-фетопротеин). Гены этих опухолевых маркеров можно использовать в качестве промоторных генов тимидинкиназы. Затем тимидинкиназа может быть активирована в клетках, экспрессирующих опухолевый маркер, но не в нормальных клетках, так что лечение ганцикловиром убивает только опухолевые клетки. Однако такие основанные на генной терапии подходы все еще являются экспериментальными, поскольку проблемы, связанные с направленным переносом гена в опухолевые клетки, еще полностью не решены.
Включение аналога тимидина с бором было предложено и опробовано на животных моделях для борной нейтронно-захватной терапии опухолей головного мозга. Было описано очень большое количество производных тимидина, содержащих бор.
Введение гена TK в геном паразита позволяет включать BrdU и тем самым делает паразита чувствительным к лечению с помощью этот препарат также был предложен и представляет собой чувствительный индикатор репликации генома паразита.
Уровни тимидинкиназы в сыворотке или плазма в основном измеряли с использованием тестов активности ферментов. В коммерческих анализах это осуществляется путем инкубации образца сыворотки с аналогом субстрата и измерения количества образовавшегося продукта. Также использовалось прямое определение белка тимидинкиназы с помощью иммуноанализа. Количество тимидинкиназы, обнаруженное этим методом, плохо коррелирует с активностью фермента. Одна из причин этого заключается в том, что большое количество TK1 в сыворотке, идентифицированное иммуноанализом, не является ферментативно активным. Это особенно верно в случае солидных опухолей, где иммуноанализы могут быть более чувствительными.
Тимидинкиназа была определена в образцах ткани после извлечения ткани. Не было разработано ни одного стандартного метода экстракции или анализа, а определение ТК в экстрактах из клеток и тканей не было подтверждено в отношении какого-либо конкретного клинического вопроса, однако см. Romain et al. и Arnér et al. Разработан метод специфического определения TK2 в клеточных экстрактах с использованием аналога субстрата 5-бромовинил 2'-дезоксиуридина. В исследованиях, упомянутых ниже, использованные методы и способ представления результатов настолько различаются, что сравнения между разными исследованиями невозможны. Уровни TK1 в тканях плода во время развития выше, чем в соответствующих тканях позже. Некоторые незлокачественные заболевания также вызывают резкое повышение значений ТК в клетках и тканях: в периферических лимфоцитах при моноцитозе и в костном мозге при пернициозной анемии. Поскольку TK1 присутствует в клетках во время деления клеток, разумно предположить, что активность TK в злокачественной ткани должна быть выше, чем в соответствующей нормальной ткани. Это также подтверждается в большинстве исследований.
Для иммуногистохимического определения доступны антитела против тимидинкиназы. Окрашивание на тимидинкиназу оказалось надежным методом идентификации пациентов с карциномой молочной железы 2 стадии. Наибольшее количество идентифицированных пациентов было получено при комбинации тимидинкиназы и окрашивания Ki-67. Этот метод также был проверен для рака легких, колоректальной карциномы, рака легких и почечно-клеточного рака.
2'-дезокси-2 ', 2'-дифтор- 5-этинилуридин (dF-EdU) связывается с тимидинкиназой вируса простого герпеса, но из-за стерических препятствий не связывается с тимидинкиназой человека. Этот реагент вместе с флуоресцентным азидом вызывают флуоресценцию инфицированных клеток, но не неинфицированных. Следовательно, этот аналог субстрата позволяет специфически окрашивать инфицированные клетки.