| ДНК-полимераза I | |||||||
|---|---|---|---|---|---|---|---|
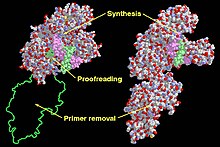 Функциональные домены во фрагменте Кленова (слева) и ДНК-полимераза I (справа). Функциональные домены во фрагменте Кленова (слева) и ДНК-полимераза I (справа). | |||||||
| Идентификаторы | |||||||
| Организм | Escherichia coli. (str. K-12 substr. MG1655) | ||||||
| Symbol | polA | ||||||
| Entrez | 948356 | ||||||
| PDB | 1DPI | ||||||
| RefSeq (Prot) | NP_418300.1 | ||||||
| UniProt | P00582 | ||||||
| Прочие данные | |||||||
| Номер EC | 2.7.7.7 | ||||||
| Хромосома | геном: 4,04 - 4,05 Мб | ||||||
| |||||||
ДНК-полимераза I (или Pol I ) представляет собой фермент, который участвует в процессе репликации прокариотической ДНК. Открытая Артуром Корнбергом в 1956 году, это была первая известная ДНК-полимераза (и первая известная полимераза ). Первоначально он был охарактеризован в E. coli и повсеместно встречается у прокариот. У E. coli и многих других бактерий ген , кодирующий Pol I, известен как polA . Форма фермента E. coli состоит из 928 аминокислот и является примером процессивного фермента - он может последовательно катализировать множественные полимеризации без высвобождения одноцепочечной матрицы. Физиологическая функция Pol I состоит в основном в восстановлении любых повреждений ДНК, но он также служит для соединения фрагментов Окадзаки путем удаления праймеров РНК и замены цепи ДНК.
В 1956 году Артур Корнберг и его коллеги обнаружили Pol I, используя Escherichia coli (E. coli) экстракты для разработки анализа синтеза ДНК. Ученые добавили тимидин, меченный С, чтобы получить радиоактивный полимер ДНК, а не РНК. Чтобы инициировать очистку ДНК-полимеразы, ученые добавили сульфат стрептомицина к экстракту E. coli, в результате чего образовался осадок, состоящий из супернатанта, не содержащего нуклеиновые кислоты (S-фракция), и осадка, содержащего нуклеиновые кислоты (P -дробная часть). Было обнаружено, что P-фракция содержит Pol I и термостабильные факторы, которые необходимы для реакций синтеза ДНК при экстремальных температурах. Эти факторы были идентифицированы как нуклеозидтрифосфаты, строительные блоки нуклеиновых кислот. S-фракция содержала несколько дезоксинуклеозидкиназ. В 1959 году Нобелевская премия по физиологии и медицине была присуждена Артуру Корнбергу и Северо Очоа "за открытие механизмов, участвующих в биологическом синтезе рибонуклеиновой кислоты и дезоксирибонуклеиновой кислоты. Кислота."
 Артур Корнберг 1969
Артур Корнберг 1969 Pol I в основном участвует в восстановлении поврежденной ДНК. Pol I является частью белков суперсемейства альфа / бета. класс, который состоит из альфа- и бета-сегментов, разбросанных по любому данному белку. E. coli ДНК Pol I состоит из четырех доменов с двумя отдельными ферментативными активностями. Четвертый домен состоит из экзонуклеазы, который проверяет продукт ДНК Pol I и способен удалять любые ошибки, допущенные Pol I. Остальные три домена работают вместе, чтобы поддерживать активность ДНК-полимеразы.
Бактерии E. coli содержат 5 различных ДНК-полимераз: ДНК Pol I, ДНК Pol II, ДНК Pol III, ДНК Pol IV и ДНК Pol V. Эукариотические клетки содержат 5 различных ДНК-полимераз: α, β, γ, δ и ε. Эукариотическая ДНК-полимераза β наиболее похожа на ДНК Pol I E. coli, потому что ее основная функция связана с репарацией ДНК, а не с репликацией. ДНК-полимераза β в основном используется для эксцизионной репарации оснований и эксцизионной репарации нуклеотидов. Всего идентифицировано 15 ДНК-полимераз человека.
 Общий связывающий примазу пептид в PolD архей и PolD эукариот
Общий связывающий примазу пептид в PolD архей и PolD эукариот В репликации ДНК ведущей цепью ДНК является непрерывно вытягивается в направлении движения репликационной вилки, в то время как отстающая цепь ДНК проходит прерывисто в противоположном направлении, как фрагменты Окадзаки. ДНК-полимеразы также не могут инициировать цепи ДНК, поэтому они должны инициироваться короткими сегментами РНК или ДНК, известными как праймеры. Для того чтобы полимеризация ДНК произошла, должны быть выполнены два требования. Прежде всего, все ДНК-полимеразы должны иметь как матричную цепь, так и цепь праймера. В отличие от РНК, ДНК-полимеразы не могут синтезировать ДНК из цепочки матрицы. Синтез должен инициироваться коротким сегментом РНК, известным как праймер РНК, синтезируемым примазой в направлении от 5 'к 3'. Затем происходит синтез ДНК путем добавления dNTP к 3'-гидроксильной группе на конце ранее существовавшей цепи ДНК или праймера РНК. Во-вторых, ДНК-полимеразы могут добавлять новые нуклеотиды к уже существовавшей цепи только за счет водородных связей. Поскольку все ДНК-полимеразы имеют схожую структуру, все они имеют механизм полимеразы, катализируемой ионами двух металлов. Один из ионов металла активирует 3'-гидроксильную группу праймера, которая затем атакует первичный 5'-фосфат dNTP. Второй ион металла будет стабилизировать отрицательный заряд выходящего кислорода и впоследствии хелатирует две существующие фосфатные группы.
Рентгеновские структуры полимеразного домена всех ДНК-полимераз, как было сказано, напоминают структуру человеческого рука. Все ДНК-полимеразы содержат три домена. Первый домен, известный как «домен пальцев», взаимодействует с dNTP и парной базой шаблона. «Домен пальцев» также взаимодействует с шаблоном, чтобы правильно разместить его на активном сайте. Второй домен, известный как «пальмовый домен», катализирует реакцию переноса фосфорильной группы. Наконец, третий домен, известный как «домен большого пальца», взаимодействует с двухцепочечной ДНК. Домен экзонуклеазы содержит собственный каталитический сайт и удаляет неправильно спаренные основания. Среди семи различных семейств ДНК-полимераз «пальмовый домен» консервативен в пяти из этих семейств. «Домен пальца» и «домен большого пальца» не согласованы в каждом семействе из-за различных элементов вторичной структуры из разных последовательностей.
Pol I обладает четырьмя ферментативными активностями:
Чтобы определить, использовался ли Pol I в первую очередь для репликации ДНК или при восстановлении повреждений ДНК был проведен эксперимент с дефицитным мутантным штаммом E. coli Pol I. Мутантный штамм, в котором отсутствовал Pol I, был изолирован и обработан мутагеном. У мутантного штамма образовались бактериальные колонии, которые продолжали нормально расти и в которых также отсутствовал Pol I. Это подтвердило, что Pol I не требовался для репликации ДНК. Однако мутантный штамм также обладал характеристиками, включающими чрезвычайную чувствительность к определенным факторам, повреждающим ДНК, таким как УФ свет. Таким образом, это еще раз подтвердило, что Pol I с большей вероятностью участвует в восстановлении повреждений ДНК, чем в репликации ДНК.
В процессе репликации РНКаза H удаляет РНК праймер (созданный примазой ) из отстающей цепи, а затем полимераза I заполняет необходимые нуклеотиды между Okazaki фрагменты (см. репликация ДНК ) в направлении 5 '→ 3', исправляя ошибки по ходу дела. Это матричный фермент - он только добавляет нуклеотиды, которые правильно пары оснований с существующей цепью ДНК, выступающей в качестве матрицы. Очень важно, чтобы эти нуклеотиды имели правильную ориентацию и геометрию для пары оснований с цепью ДНК-матрицы, чтобы ДНК-лигаза могла соединять различные фрагменты вместе в непрерывную цепочку ДНК. Исследования полимеразы I подтвердили, что разные dNTP могут связываться с одним и тем же активным сайтом на полимеразе I. Полимераза I способна активно различать разные dNTP только после того, как она претерпевает конформационное изменение. Как только это изменение произошло, Pol I проверяет правильность геометрии и правильное выравнивание пары оснований, образованной между связанным dNTP и соответствующей основой на цепи шаблона. Правильная геометрия пар оснований A = T и G≡C - единственная, которая может соответствовать активному сайту. Однако важно знать, что один из каждых 10-10 нуклеотидов добавлен неправильно. Тем не менее Pol I может исправить эту ошибку в репликации ДНК, используя свой селективный метод активного различения.
Несмотря на раннюю характеристику, быстро стало очевидно, что полимераза I не была ферментом, ответственным за большую часть синтеза ДНК - репликация ДНК в E. coli протекает со скоростью приблизительно 1000 нуклеотидов в секунду, тогда как скорость синтеза пар оснований полимеразой I составляет в среднем только от 10 до 20 нуклеотидов в секунду. Более того, его клеточная численность, составляющая приблизительно 400 молекул на клетку, не коррелировала с тем фактом, что в E. coli обычно есть только две репликационные вилки. Кроме того, процессивно недостаточно для копирования всего генома, поскольку он отваливается после включения только 25–50 нуклеотидов. Его роль в репликации была доказана, когда в 1969 году Джон Кэрнс выделил жизнеспособный мутант полимеразы I , у которого отсутствовала полимеразная активность. Лаборант Кэрнса, Паула Де Люсия, создала тысячи бесклеточных экстрактов из колоний E. coli и проанализировала их на ДНК-полимеразную активность. 3478-й клон содержал мутант polA, названный Кэрнсом в честь «Паулы» [Де Люсия]. Только после открытия ДНК-полимеразы III основная репликативная ДНК-полимераза была окончательно идентифицирована.
 ДНК-полимераза I: фрагмент Кленова (PDB 1KLN EBI)
ДНК-полимераза I: фрагмент Кленова (PDB 1KLN EBI) ДНК-полимераза I, полученная из E. coli, широко используется для исследований в области молекулярной биологии. Однако активность экзонуклеазы 5 '→ 3' делает его непригодным для многих приложений. Эту нежелательную ферментативную активность можно просто удалить из холоэнзима, чтобы оставить полезную молекулу, называемую фрагментом Кленова, широко используемую в молекулярной биологии. Фактически, фрагмент Кленова использовался во время первых протоколов полимеразной цепной реакции (ПЦР) амплификации до Thermus aquaticus, источника термостойкой Taq-полимеразы I, был открыт в 1976 году. Воздействие на ДНК-полимеразу I протеазы субтилизин расщепляет молекулу на меньший фрагмент, который сохраняет только активность ДНК-полимеразы и корректора.