Валозин-содержащий белок (VCP ) или АТФаза переходного эндоплазматического ретикулума (АТФаза TER ), также известный как или p97 у млекопитающих и CDC48 у S. cerevisiae, представляет собой фермент, который у человека кодируется геном VCP . TER-АТФаза представляет собой фермент АТФаза, присутствующий во всех эукариотах и архебактериях. Его основная функция состоит в том, чтобы отделить белковые молекулы от крупных клеточных структур, таких как белковые сборки, мембраны органелл и хроматин, и, таким образом, облегчить деградацию высвобожденных полипептидов многосубъединичной протеазой протеасомой.
p97. / CDC48 является членом семейства АТФаз AAA + (расширенное семейство АТФаз, связанных с различными клеточными активностями). Ферменты этого семейства встречаются у всех видов, от бактерий до людей. Многие из них являются важными шаперонами, которые регулируют сворачивание или разворачивание субстратных белков. p97 / CDC48 является ААА + АТФазой типа II, что означает, что он содержит два тандемных домена АТФазы (названные D1 и D2 соответственно) (Рисунок 1 ).
Два домена АТФазы соединены коротким полипептидным линкером. Домен, предшествующий домену D1 (N-концевой домен), и короткий карбоксиконцевой хвост вовлечены во взаимодействие с кофакторами. N-домен соединен с доменом D1 коротким линкером N-D1.
Большинство известных субстратов p97 / CDC48 модифицированы цепями убиквитина и расщепляются 26S протеасомой. Соответственно, многие коферменты и адаптеры p97 / CDC48 имеют домены, которые могут распознавать убиквитин. Стало очевидным, что взаимодействия между ubiquitin и кофакторами p97 / CDC48 критичны для многих из предполагаемых функций, хотя точная роль этих взаимодействий еще предстоит выяснить.
CDC48 был обнаружен в ходе генетического скрининга генов, участвующих в регуляции клеточного цикла у почкующихся дрожжей. Скрининг выявил несколько аллелей Cdc48, которые влияют на рост клеток при недопустимых температурах. Гомолог CDC48 у млекопитающих первоначально был охарактеризован как предшественник белка массой 97 кДа для малого пептида валозина. Поэтому он был назван валозин-содержащим белком (VCP) или p97, но последующие исследования показали, что валозин является артефактом очистки, не связанным с p97. Тем не менее, номенклатура VCP все еще используется в литературе.
p97 / CDC48 является одним из наиболее распространенных цитоплазматических белков в эукариотических клетках. Он повсеместно экспрессируется во всех тканях многоклеточных организмов. Было обнаружено, что у человека экспрессия мРНК p97 умеренно повышена при некоторых типах рака.
В клетках млекопитающих p97 преимущественно локализован в цитоплазме, а значительная часть связана с мембранами клеточных органелл, таких как как эндоплазматический ретикулум (ЭР), Гольджи, митохондрии и эндосомы. Субклеточная локализация CDC48 полностью не охарактеризована, но, вероятно, подобна его аналогу у млекопитающих. Фракция p97 / CDC48 также была обнаружена в ядре.
Согласно кристаллическим структурам полноразмерного p97 дикого типа, шесть субъединиц p97 собираются в бочкообразную структуру, в котором домены N-D1 и D2 образуют два концентрических, уложенных друг на друга кольца (Рисунок 2).
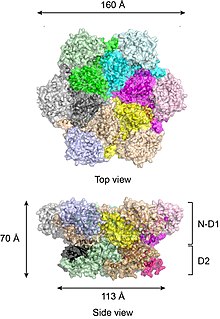 Рисунок 2- Структура p97. Шесть субъединиц показаны в виде молекулярной поверхности разными цветами. Домены каждой субъединицы также по-разному закрашены. Представлены два вида. Эта структура представляет собой p97 в связанном с ADP состоянии.
Рисунок 2- Структура p97. Шесть субъединиц показаны в виде молекулярной поверхности разными цветами. Домены каждой субъединицы также по-разному закрашены. Представлены два вида. Эта структура представляет собой p97 в связанном с ADP состоянии. Кольцо N-D1 больше (162 Å в диаметре), чем кольцо D2 (113 Å) из-за латерально прикрепленных N-доменов. Домены D1 и D2 очень гомологичны как по последовательности, так и по структуре, но они выполняют разные функции. Например, для гексамерной сборки p97 требуется только домен D1, но не домен D2. В отличие от многих бактериальных белков AAA + сборка гексамера p97 не зависит от присутствия нуклеотида. Гексамерная сборка p97 может претерпевать драматические конформационные изменения во время цикла гидролиза нуклеотидов, и обычно считается, что эти конформационные изменения генерируют механическую силу, которая прикладывается к молекулам субстрата, чтобы влиять на их стабильность и функцию. Однако неясно, как именно p97 генерирует силу.
Гидролизирующая активность АТФ необходима для функций p97 / CDC48. Два домена АТФазы р97 (D1 и D2) не эквивалентны, потому что домен D2 проявляет более высокую активность АТФазы, чем домен D1 в белке дикого типа. Тем не менее их деятельность зависит друг от друга. Например, связывание нуклеотидов с доменом D1 необходимо для связывания АТФ с доменом D2, а связывание нуклеотидов и гидролиз в D2 требуется для домена D1 для гидролиза АТФ.
На АТФазную активность p97 может влиять множество факторов. Например, его можно стимулировать нагреванием или предполагаемым белком-субстратом. У Leishmania infantum белок LiVCP необходим для внутриклеточного развития паразита и его выживания в условиях теплового стресса. Ассоциация с кофакторами может иметь положительное или отрицательное влияние на активность АТФазы p97.
Мутации в p97 также могут влиять на его активность. Например, мутантные белки p97, несущие точечные мутации, обнаруженные у пациентов с мультисистемной протеинопатией (MSP; ранее известная как IBMPFD (миопатия с тельцами включения, связанная с болезнью Педжета и лобно-височной деменцией)) (см. Ниже), Увеличение активности АТФазы в 2-3 раза.
Недавние протеомные исследования идентифицировали большое количество p97-взаимодействующих белков. Многие из этих белков служат адаптерами, которые связывают p97 / CDC48 с определенным субклеточным компартментом для функционирования в определенном клеточном пути. Другие функционируют как адаптеры, которые привлекают субстраты к p97 / CDC48 для обработки. Некоторые белки, взаимодействующие с p97, также являются ферментами, такими как N-гликаназа, убиквитинлигаза и деубиквитиназа, которые помогают p97 в обработке субстратов.
Большинство кофакторов связывают p97 / CDC48 через его N-домен, но некоторые взаимодействуют с коротким карбокси-концевым хвостом в p97 / CDC48. Репрезентативными белками, взаимодействующими с N-доменом, являются Ufd1, Npl4, p47 и FAF1. Примерами кофакторов, которые взаимодействуют с карбокси-концевым хвостом p97, являются PLAA, PNGase и Ufd2.
Молекулярные основы связывания кофакторов были изучены для некоторых кофакторов, которые взаимодействуют с N-доменом p97. N-домен состоит из двух субдоменов примерно равного размера: N-концевого двойного Y-образного цилиндра и C-концевого b-образного цилиндра (Рисунок 3 ).
 Рис. 3. Структура N-домена p97. N-домен изображен в виде молекулярной поверхности, наложенной на ленточное изображение.
Рис. 3. Структура N-домена p97. N-домен изображен в виде молекулярной поверхности, наложенной на ленточное изображение. Структурные исследования показывают, что многие кофакторные белки связываются с N-доменом в щели, образованной между двумя субдоменами.
Среди тех, которые связываются с N-доменом p97, обнаружены два наиболее часто встречающихся мотива последовательности: один называется мотивом UBX (регуляторный X убиквитина), а другой - VIM (мотив, взаимодействующий с VCP). Домен UBX представляет собой модуль из 80 остатков со складкой, очень напоминающей структуру убиквитина. Мотив, взаимодействующий с VCP (VIM), представляет собой мотив линейной последовательности (RX 5 AAX 2 R), обнаруженный в ряде кофакторов p97, включая gp78, SVIP (малый белок, ингибирующий VCP). и VIMP (мембранный белок, взаимодействующий с VCP). Хотя домен UBX использует поверхностную петлю, тогда как VIM формирует а-спираль для связывания p97, и UBX, и VIM связываются в одном и том же месте между двумя субдоменами N-домена (рис. 3 ). Было высказано предположение, что иерархическое связывание с отдельными кофакторами может иметь важное значение для широких функций p97 / CDC48.
p97 / CDC48 выполняет разнообразные функции, модулируя стабильность и, следовательно, активность его субстраты. Общая функция p97 / CDC48 состоит в том, чтобы отделить белки от большой белковой сборки или неподвижных клеточных структур, таких как мембраны или хроматин, позволяя высвобожденным белковым молекулам расщепляться протеасомой. Функции p97 / CDC48 можно разделить на следующие три основные категории.
Лучше всего охарактеризованная функция p97 заключается в посредничестве сети процессов контроля качества белка для поддержания гомеостаза белка. К ним относятся деградация белков, связанная с эндоплазматическим ретикулумом (ERAD) и деградация, связанная с митохондриями. В этих процессах гидролиз АТФ с помощью p97 / CDC48 необходим для извлечения аберрантных белков из мембран ER или митохондрий. p97 / CDC48 также необходим для высвобождения дефектных продуктов трансляции, остановившихся на рибосомах, в процессе, называемом деградацией, связанной с рибосомами. Похоже, что только после экстракции из мембран или большой сборки белка, такой как рибосома, протеасома может расщеплять полипептиды. Помимо этой «сегрегазной» функции, p97 / CDC48 может играть дополнительную роль в транспортировке высвобождаемых полипептидов в протеасому. Эта функция шаперонирования, по-видимому, особенно важна для деградации некоторых склонных к агрегации неправильно свернутых белков в ядре. Несколько линий доказательств также указывают на участие p97 в аутофагии, процессе, который превращает клеточные белки (включая неправильно свернутые), поглощая их в пузырьки, окруженные двойной мембраной, которые называются аутофагосомами, но точная роль p97 в этом процессе неясна.
p97 также широко функционирует в ядре эукариот, высвобождая белковые молекулы из хроматинов аналогично тому, как это происходит в ERAD. Идентифицированные субстраты p97 включают репрессор транскрипции α2 и комплекс РНК-полимеразы (Pol) II и ДНК-геликазу CMG в почкующихся дрожжах, а также реплицирующий ДНК фактор лицензирования CDT1, репаративные белки ДНК DDB2 и XPC, регулятор митоза Aurora B и некоторые ДНК-полимеразы у млекопитающих. клетки. Эти субстраты связывают функцию p97 с транскрипцией гена, репликацией и репарацией ДНК, а также с развитием клеточного цикла.
Биохимические и генетические исследования также показали, что p97 участвует в слиянии везикул, что приводит к образованию аппарата Гольджи в конце митоза. Этот процесс требует адаптера связывания убиквитина p47 и ассоциированной с p97 деубиквитиназы VCIP135 и, таким образом, соединения мембранного слияния с путями убиквитина. Однако точная роль p97 в образовании Гольджи неясна из-за отсутствия информации о соответствующих субстратах. Недавние исследования также предполагают, что p97 может регулировать перенос везикул от плазматической мембраны к лизосомам, процесс, называемый эндоцитозом.
Мутации в VCP были Вирджиния Кимонис впервые сообщила, что вызывает синдром, характеризующийся лобно-височной деменцией и костной болезнью Педжета. В 2010 году мутации в VCP также оказались причиной боковой амиотрофический склероз, авторы Брайан Трейнор и Адриано Чио. Это открытие было примечательно, поскольку оно представляло собой первоначальную генетическую связь между двумя несопоставимыми неврологическими заболеваниями, боковым амиотрофическим склерозом и лобно-височной деменцией.
Мутации в VCP представляют собой пример плейотропии, когда мутации в одном и том же гене вызывают разные фенотипы. Термин мультисистемная протеинопатия (MSP) был придуман для описания этой конкретной формы плейотропии. Хотя MSP встречается редко, растущий интерес к этому синдрому происходит из-за молекулярных представлений, которые это состояние обеспечивает в этиологической взаимосвязи между распространенными возрастными дегенеративными заболеваниями мышц, костей и мозга. Было подсчитано, что ~ 50% MSP может быть вызвано миссенс-мутациями, влияющими на ген валозинсодержащего белка (VCP).
.
Первый ингибитор p97 (EerI) был обнаружен путем скрининга и характеризующие соединения, которые ингибируют деградацию меченного флуоресценцией субстрата ERAD. Механизм ингибирования p97 с помощью EerI неясен, но при применении к клеткам он индуцирует биологические фенотипы, связанные с ингибированием p97, такие как ингибирование ERAD, повышение стресса ER и индукция апоптоза. Важно отметить, что EerI проявляет значительную противораковую активность in vitro, предпочтительно против раковых клеток, выделенных от пациентов, и может действовать синергетически с ингибитором протеасом бортезомибом для уничтожения раковых клеток. Эти наблюдения наталкивают на мысль о нацеливании на p97 в качестве потенциальной терапии рака. Эта идея была дополнительно подтверждена изучением нескольких конкурентных и аллостерических ингибиторов АТФ. Совсем недавно был разработан мощный и специфический ингибитор p97 CB-5083, который демонстрирует многообещающую противораковую активность на моделях опухолей ксенотрансплантата мышей. В настоящее время соединение оценивается в рамках клинического испытания фазы 1.