| Пантотенаткиназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| ЕС нет. | 2.7.1.33 | ||||||||
| № CAS | 9026-48-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Пантотенаткиназа ( EC 2.7.1.33, PanK; CoaA) является первым ферментом в пути биосинтеза кофермента A (CoA). Он фосфорилирует пантотенат (витамин B 5) с образованием 4'-фосфопантотената за счет молекулы аденозинтрифосфата ( АТФ ). Это ограничивающий скорость шаг в биосинтезе КоА.
![[2]](https://upload.wikimedia.org/wikipedia/commons/3/34/Mechanism_os_pantothenate_kinase.png)
КоА - необходимый кофактор для всех живых организмов. Он действует как основной носитель ацильной группы во многих важных клеточных процессах, таких как цикл лимонной кислоты ( цикл трикарбоновых кислот ) и метаболизм жирных кислот. Следовательно, пантотенаткиназа является ключевым регуляторным ферментом в пути биосинтеза КоА.
Было идентифицировано три различных типа PanK - PanK-I (обнаружен у бактерий), PanK-II (в основном обнаружен у эукариот, но также и у стафилококков ) и PanK-III, также известный как CoaX (обнаружен у бактерий). Эукариотические ферменты PanK-II часто встречаются в виде разных изоформ, таких как PanK1, PanK2, PanK3 и PanK4. У человека несколько изоформ PanK экспрессируются четырьмя генами. Ген PANK1 кодирует формы PanK1α и PanK1β, а PANK2 и PANK3 кодируют PanK2 и PanK3 соответственно.
 Рис.1 Димерная структура PanK-II
Рис.1 Димерная структура PanK-II PanK-II содержит два белковых домена, как показано на рисунке 1. Каждый домен A и A 'имеет богатую глицином петлю (последовательность GXXXXGKS; петля P ), которая характерна для сайтов связывания нуклеотидов ; это где АТФ предполагается для связывания. расположен между остатками 95 и 102 в домене A
Два сайта связывания АТФ демонстрируют совместное поведение. Интерфейс димеризации состоит из двух длинных спиралей, по одной от каждого мономера, которые взаимодействуют друг с другом. В С-концевые концы спиралей удерживаются вместе ван - дер - ваальсовых взаимодействий между валина и метионина остатков каждого мономера. Середина спиралей соединена водородными связями между остатками аспарагина. На N- конце каждая спираль расширяется и образует четырехспиральный пучок с двумя более короткими спиралями. Этот пучок состоит из гидрофобного ядра, образованного неполярными остатками, которые используют силы Ван-дер-Ваальса для дальнейшей стабилизации димера.
В активном центре пантотенат ориентирован водородными связями между пантотенатом и боковыми цепями остатков аспартата, тирозина, гистидина, тирозина и аспарагина. В катализе участвуют остатки аспарагина, гистидина и аргинина.
Изоформы PanK-II человека PanK1α, PanK1β, PanK2 и PanK3 имеют общее высокогомологичное каталитическое ядро из примерно 355 остатков. PanK1α и PanK1β оба кодируются геном PANK1 и имеют один и тот же каталитический домен из 363 аминокислот, кодируемый экзонами 2-7. Транскрипт PanK1α начинается с экзона 1α, который кодирует регуляторный домен из 184 остатков на N-конце. Эта область обеспечивает ингибирование с помощью обратной связи свободным КоА и ацил-КоА и регулирование ацетил-КоА и малонил-КоА. С другой стороны, транскрипт PanK1β начинается с экзона 1β, который дает N-конец из 10 остатков, который не включает регуляторный домен обратной связи.
 Рис.2 Димерная структура PanK-III
Рис.2 Димерная структура PanK-III PanK-III также содержит два белковых домена, и ключевые каталитические остатки PanK-II законсервированы. Мономерные звенья PanK-II и PanK-III практически идентичны, но имеют совершенно разные димерные сборки. Исследование структур Staphylococcus aureus типа II и Pseudomonas aeruginosa типа III демонстрирует, что мономер PanK-II имеет петлевой участок, который отсутствует в мономере PanK-III, а мономер PanK-III имеет петлевой участок, который отсутствует. из мономера ПанК-II. Это незначительное изменение имеет решающее различие на границе димеризации, в которой спирали димера PanK-II скручиваются друг вокруг друга, а спирали димера PanK-III взаимодействуют под углом 70 ° (Рис. 2).
В результате этого различия в интерфейсе димеризации между PanK-II и PanK-III, конформации сайтов связывания субстрата для АТФ и пантотената также различны.
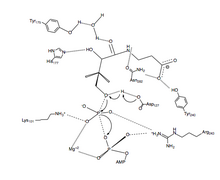 Рис. 3 Предлагаемый каталитический механизм для PanK-II
Рис. 3 Предлагаемый каталитический механизм для PanK-II Предлагаемый механизм реакции переноса фосфорила PanK-II представляет собой согласованный механизм с диссоциативным переходным состоянием.
Во-первых, АТФ связывается в связывающей бороздке, созданной остатками петли Р и соседними остатками. Здесь консервативный лизин ( Lys-101 ) является ключевым остатком, необходимым для связывания АТФ. Кроме того, боковые цепи остатков Lys-101, Ser-102, Glu-199 и Arg-243 ориентируют нуклеотид в связывающей бороздке. Пантотенат связан и ориентированный путем формирования взаимодействия водородных связей с остатками Asp-127, Tyr-240, Asn-282, Tyr-175 и His-177. Когда связаны и АТФ, и пантотенат, Asp-127 депротонирует C1- гидроксильную группу пантотената. Затем кислород из пантотената атакует γ-фосфат связанного АТФ. Здесь стабилизация заряда β- и γ-фосфатных групп достигается с помощью Arg-243, Lys-101 и координированного иона Mg 2+. В этом согласованном механизме планарный фосфоран γ-фосфата передается в линию атакующему кислороду пантотената. Наконец, 4'-фосфопантотенат отделяется от PanK, а затем от АДФ.
Регулирование пантотенаткиназы важно для контроля внутриклеточной концентрации КоА. Пантотенаткиназа регулируется посредством ингибирования по принципу обратной связи КоА и его тиоэфиров (например, ацетил-КоА, малонил-КоА ). КоА подавляет активность PanK путем конкурентного связывания с сайтом связывания АТФ и предотвращения связывания АТФ с Lys-101.
Хотя КоА связывается в том же сайте, что и АТФ, они связываются в разных ориентациях, и их адениновые части взаимодействуют с ферментом с неперекрывающимися наборами остатков. His-177, Phe-247 и Arg-106 необходимы для распознавания КоА, но не для АТФ, и в то время как Asn-43 и His-307 взаимодействуют с адениновым основанием АТФ, His-177 и Phe-247 взаимодействуют с аденином. база CoA. Обе молекулы используют Lys-101 для нейтрализации заряда соответствующих фосфодиэфиров.
Неэтерифицированный КоА обладает более сильным ингибирующим действием, чем его тиоэфиры. Этот феномен лучше всего объясняется плотным прилеганием тиоловой группы к окружающим ароматическим остаткам Phe-244, Phe-259, Tyr-262 и Phe-252. Свободный КоА оптимально подходит, но когда ацильная группа присоединена к КоА, стерические препятствия затрудняют взаимодействие тиоэфира с Phe-252. Таким образом, ингибирование тиоэфирами менее эффективно, чем ингибирование неэтерифицированным КоА.
Вышеуказанное положение соответствует PanK-II. PanK-III устойчив к подавлению обратной связи.
В людях:
Ген PANK2 кодирует PanK2, который регулирует образование КоА в митохондриях, центрах производства энергии клетки. Мутация PANK2 является причиной нейродегенерации, связанной с пантотенаткиназой, ранее называвшейся синдромом Халлервордена-Шпатца. Это редкое заболевание проявляется глубокой дистонией, спастичностью и часто приводит к летальному исходу.