| Staphylococcus aureus | |
|---|---|
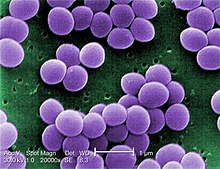 | |
| Сканирующая электронная микрофотография S. aureus; ложный цвет добавлен | |
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Фирмикуты |
| Класс: | Бациллы |
| Порядок: | Бациллы |
| Семейство: | Staphylococcaceae |
| Род: | Staphylococcus |
| Виды: | S. aureus |
| Биномиальное название | |
| Staphylococcus aureus . Rosenbach 1884 | |
| Staphylococcus aureus | |
|---|---|
| Другие названия | Staph aureus, S. aureus |
| Специальность | Инфекционная болезнь |
 Staphylococcus aureus на основных средах культивирования
Staphylococcus aureus на основных средах культивирования 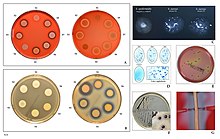 Гемолиз на кровяном агаре, активность ДНКазы, фактор слипания, агглютинация латекса, рост на маннитоловой соли и агаре Байрда-Паркера, выработка гиалуронидазы.
Гемолиз на кровяном агаре, активность ДНКазы, фактор слипания, агглютинация латекса, рост на маннитоловой соли и агаре Байрда-Паркера, выработка гиалуронидазы. Staphylococcus aureus - грамм- положительная, круглообразная бактерия, которая является членом Firmicutes и является обычным членом микробиоты тела, часто обнаруживается в верхних дыхательных путях и на коже. Он часто является положительным для каталазы и восстановления нитратов и является факультативным анаэробом, который может расти без потребности в кислороде. Хотя S. aureus обычно действует как комменсал микробиоты человека, он также может стать оппортунистическим патогеном, являясь частой причиной кожных инфекций, включая абсцессы, респираторные инфекции такие как синусит и пищевое отравление. Патогенные штаммы часто вызывают инфекции, продуцируя факторы вирулентности, такие как сильнодействующие белковые токсины, и экспрессию клеточной поверхности белок, который связывает и инактивирует антитела. Появление устойчивых к антибиотикам штаммов S. aureus, таких как метициллин-устойчивый S. aureus (MRSA), является глобальной проблемой клинической медицины. Несмотря на многочисленные исследования и разработки, ни одна вакцина против S. aureus не была одобрена.
Примерно от 20% до 30% населения являются долгосрочными носителями S. aureus, который можно найти как часть нормальной кожной флоры в ноздрях, и как нормальный житель нижних репродуктивных путей женщин. S. aureus может вызывать ряд заболеваний, от незначительных кожных инфекций, таких как прыщи, импетиго, фурункулы, целлюлит, фолликулит, карбункулы, синдром ошпаренной кожи и абсцессы, до опасных для жизни заболеваний, таких как пневмония, менингит, остеомиелит, эндокардит, синдром токсического шока, бактериемия и сепсис. Это по-прежнему одна из пяти наиболее частых причин внутрибольничных инфекций и часто является причиной раневых инфекций после хирургических вмешательств. Ежегодно около 500 000 пациентов в больницах США заболевают стафилококковой инфекцией, главным образом S. aureus. До 50 000 смертей ежегодно в США связаны с инфекциями S. aureus.
В 1881 году сэр Александр Огстон, шотландский хирург, обнаружил, что стафилококк может вызывать раневые инфекции, после того, как заметил группы бактерий в гное. из хирургического абсцесса во время процедуры, которую он выполнял. Он назвал его стафилококком в честь его скопления, видимого под микроскопом. Затем, в 1884 году, немецкий ученый Фридрих Юлиус Розенбах идентифицировал золотистый стафилококк, выделив и отделив его от Staphylococcus albus, родственной бактерии. В начале 1930-х годов врачи начали использовать более оптимизированный тест для обнаружения инфекции S. aureus с помощью теста на коагулазу, который позволяет обнаруживать фермент, продуцируемый бактерией. До 1940-х годов инфекции, вызванные S. aureus, были смертельными для большинства пациентов. Однако врачи обнаружили, что использование пенициллина может вылечить инфекции S. aureus. К сожалению, к концу 1940-х годов устойчивость к пенициллину стала широко распространенной среди этой популяции бактерий, и стали происходить вспышки устойчивого штамма.
Staphylococcus aureus может быть разделены на десять доминирующих человеческих родословных. Есть также множество второстепенных линий, но они не так часто встречаются в популяции. Геномы бактерий одной линии в основном консервативны, за исключением мобильных генетических элементов. Мобильные генетические элементы, которые являются общими для S. aureus, включают бактериофаги, островки патогенности, плазмиды, транспозоны и стафилококковые кассетные хромосомы. Эти элементы позволили S. aureus постоянно развиваться и приобретать новые черты. Внутри видов S. aureus существует множество генетических вариаций. Исследование Fitzgerald et al. (2001) выявили, что примерно 22% генома S. aureus не кодирует и поэтому может отличаться от бактерии к бактерии. Пример этой разницы виден в вирулентности видов. Лишь несколько штаммов S. aureus связаны с инфекциями у людей. Это демонстрирует, что существует широкий диапазон инфекционной способности внутри вида.
Было высказано предположение, что одной из возможных причин большой гетерогенности внутри вида может быть его зависимость от гетерогенных инфекций. Это происходит, когда несколько различных типов S. aureus вызывают инфекцию у хозяина. Различные штаммы могут секретировать разные ферменты или вызывать у группы разную устойчивость к антибиотикам, увеличивая ее патогенную способность. Таким образом, существует потребность в большом количестве мутаций и приобретений мобильных генетических элементов.
Еще одним заметным эволюционным процессом внутри вида S. aureus является его совместная эволюция с человеческими хозяевами. Со временем эти паразитарные отношения привели к тому, что бактерия стала переноситься в носоглотке человека, не вызывая симптомов или инфекции. Это позволяет ему распространяться среди людей, повышая его приспособленность как вид. Однако только около 50% населения являются носителями S. aureus, причем 20% - постоянные носители, а 30% - прерывистые. Это заставляет ученых полагать, что существует множество факторов, определяющих, распространяется ли S. aureus бессимптомно у людей, включая факторы, специфичные для конкретного человека. Согласно исследованию Хофмана и др. 1995 г., эти факторы могут включать возраст, пол, диабет и курение. Они также определили некоторые генетические вариации у людей, которые приводят к повышенной способности S. aureus колонизировать, в частности, полиморфизм в гене рецептора глюкокортикоидов, который приводит к большему производству кортикостероидов. В заключение, есть доказательства того, что любой штамм этой бактерии может стать инвазивным, так как это сильно зависит от человеческих факторов.
Хотя S. aureus имеет быструю репродуктивную и микроэволюционную скорость, существует множество препятствий, мешающих эволюция с видом. Одним из таких барьеров является AGR, который является глобальным регулятором дополнительных генов бактерий. Этот регулятор был связан с уровнем вирулентности бактерий. Было обнаружено, что мутации потери функции в этом гене увеличивают приспособленность бактерий, содержащих его. Таким образом, S. aureus должен пойти на компромисс, чтобы увеличить свой успех как вида, заменив пониженную вирулентность на повышенную устойчивость к лекарствам. Еще одним препятствием для эволюции является система рестрикционных модификаций (RM) Sau1 Type I. Эта система существует для защиты бактерии от чужеродной ДНК путем ее переваривания. Обмен ДНК между одними и теми же линиями не блокируется, поскольку они имеют одинаковые ферменты, и система RM не распознает новую ДНК как чужеродную, но передача между линиями блокируется.
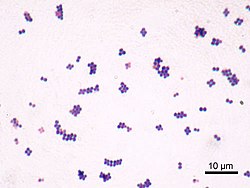 Окраска по Граму С. saprophyticus, которые обычно располагаются в кластерах: клеточная стенка легко впитывает окрашивание кристаллическим фиолетовым.
Окраска по Граму С. saprophyticus, которые обычно располагаются в кластерах: клеточная стенка легко впитывает окрашивание кристаллическим фиолетовым.  Ключевые характеристики Staphylococcus aureus
Ключевые характеристики Staphylococcus aureus S. aureus (, греч. σταφυλόκοκκος, «гроздь винограда», латинское aureus, «золотой») - это факультативно анаэробная, грамположительная кокковая (круглая) бактерия, также известная как «золотой стафилококк» и «оростафира». S. aureus неподвижен и не образует спор. В медицинской литературе бактерия часто упоминается как S. aureus, Staph aureus или Staph a. S. aureus при просмотре под микроскопом выглядит как стафилококки (гроздья винограда) и имеет большие круглые золотисто-желтые колонии., часто с гемолизом, при выращивании на чашках с кровяным агаром. S. aureus воспроизводит бесполым путем посредством двойного деления. Полное разделение дочерних клеток опосредуется S. aureus автолизином, и в его отсутствие или при целевом ингибировании дочерние клетки остаются прикрепленными друг к другу и появляются в виде кластеров.
С. aureus положительна по каталазе (что означает, что он может продуцировать фермент каталазу). Каталаза превращает перекись водорода (H. 2O. 2) в воду и кислород. Тесты на активность каталазы иногда используются для отличия стафилококков от энтерококков и стрептококков. Ранее S. aureus отличался от других стафилококков с помощью теста на коагулазу. Однако не все штаммы S. aureus являются коагулазо-положительными, и неправильная идентификация вида может повлиять на эффективное лечение и меры контроля.
Staphylococcus отличается от так называемого и имеющего медицинское значение рода Streptococcus.
Естественная генетическая трансформация - это репродуктивный процесс, включающий перенос ДНК от одной бактерии к другой через промежуточную среду и интеграцию донорной последовательности в геном реципиента посредством гомологичной рекомбинации. Было обнаружено, что S. aureus способен к естественной генетической трансформации, но только с низкой частотой в используемых экспериментальных условиях. Дальнейшие исследования показали, что развитие способности к естественной генетической трансформации может быть значительно выше в соответствующих условиях, но еще предстоит открыть.
У людей S. aureus может присутствовать в верхние дыхательные пути, слизистая оболочка кишечника и кожа как член нормальной микробиоты. Однако, поскольку S. aureus может вызывать заболевание при определенных условиях хозяина и окружающей среды, он характеризуется как «патобионт».
 3D-медицинская анимация все еще снимает костный остеомиелит
3D-медицинская анимация все еще снимает костный остеомиелит  2005 г. сканирующая электронная микрофотография (SEM) показывает многочисленные скопления метициллин-устойчивых бактерий S. aureus (MRSA).
2005 г. сканирующая электронная микрофотография (SEM) показывает многочисленные скопления метициллин-устойчивых бактерий S. aureus (MRSA). Хотя S. aureus обычно действует как комменсальная бактерия, бессимптомно колонизируя около 30% человеческой популяции, он иногда может вызывать болезни. В частности, S. aureus является одной из наиболее частых причин бактериемии и инфекционного эндокардита. Кроме того, он может вызвать различные инфекции кожи и мягких тканей, особенно когда нарушены кожные или слизистые барьеры.
С. aureus могут передаваться через контакт с гноем из инфицированной раны, контакт кожа к коже с инфицированным человеком и контакт с предметами, которыми пользуется инфицированный человек, такими как полотенца, простыни, одежду или спортивное снаряжение. Замена суставов подвергает человека особому риску септического артрита, стафилококкового эндокардита (инфекция сердечных клапанов) и пневмонии.
Профилактические меры часто мыть руки с мылом и ежедневно принимать ванну или душ.
С. aureus является важной причиной хронических инфекций биопленки на медицинских имплантатах, а репрессор токсинов является частью пути заражения.
S. aureus может бездействовать в организме в течение многих лет незамеченными. Как только симптомы начинают проявляться, хозяин заразен еще две недели, а общее заболевание длится несколько недель. Однако при отсутствии лечения болезнь может быть смертельной. Глубоко проникающие инфекции S. aureus могут быть тяжелыми.
Кожные инфекции являются наиболее распространенной формой инфекции S. aureus. Это может проявляться по-разному, включая небольшие доброкачественные фурункулы, фолликулит, импетиго, целлюлит и более серьезные инвазивные поражения мягких тканей. инфекции.
S. aureus чрезвычайно распространен у людей с атопическим дерматитом, более известным как экзема. В основном он встречается в плодородных, активных местах, включая подмышки, волосы и кожу головы. Большие прыщики, появляющиеся на этих участках, могут усугубить инфекцию, если их разорвать. Это может привести к стафилококковому синдрому ошпаренной кожи, тяжелая форма которого может наблюдаться у новорожденных.
. Наличие S. aureus у лиц с атопическим дерматитом не является показанием для лечения пероральными препаратами. антибиотики, поскольку фактические данные не показали, что это приносит пользу пациенту. Однако было обнаружено, что местные антибиотики в сочетании с кортикостероидами улучшают состояние. Колонизация S. aureus вызывает воспаление атопического дерматита; Считается, что S. aureus использует дефекты кожного барьера у людей с атопическим дерматитом, вызывая экспрессию цитокинов и, следовательно, обостряя симптомы.
S. aureus также вызывает пищевое отравление. Он способен вырабатывать токсины, вызывающие пищевое отравление в организме человека. Инкубационный период длится от одного до шести часов, а сама болезнь длится от 30 минут до 3 дней. Профилактические меры, которые можно предпринять для предотвращения распространения болезни, включают тщательное мытье рук водой с мылом перед приготовлением пищи. В случае болезни держитесь подальше от любой пищи и надевайте перчатки, если на руках или запястьях есть открытые раны во время приготовления пищи. Если еда хранится более 2 часов, держите ее ниже 5 или выше 63 ° C.
S. aureus - это бактерия, обычно ответственная за все основные инфекции костей и суставов. Это проявляется в одной из трех форм: остеомиелит, септический артрит и инфекция в результате операции по замене сустава.
С. aureus - основная причина инфекций кровотока во многих промышленно развитых странах. Инфекция обычно связана с повреждениями кожи или слизистых оболочек в результате хирургического вмешательства, травмы или использования внутрисосудистых устройств, таких как катетеры, аппараты для гемодиализа или инъекции наркотики. Попав в кровоток, бактерии могут инфицировать различные органы, вызывая инфекционный эндокардит, септический артрит и остеомиелит. Это заболевание особенно распространено и тяжело у очень молодых и очень старых.
Без лечения бактериемией S. aureus летальность составляет около 80%. При лечении антибиотиками летальность составляет от 15% до 50% в зависимости от возраста и состояния здоровья пациента, а также устойчивости штамма S. aureus к антибиотикам.
С. aureus часто встречается в биопленках, образованных на медицинских устройствах, имплантированных в тело или на ткани человека. Обычно он встречается с другим патогеном, Candida albicans, образуя многовидовые биопленки. Предполагается, что последний помогает S. aureus проникать в ткани человека. Более высокая смертность связана с многовидовыми биопленками.
S. Биопленка aureus является основной причиной инфекций, связанных с ортопедическими имплантатами, но также обнаруживается на сердечных имплантатах, сосудистых трансплантатах, различных катетерах и косметических хирургических имплантатах. После имплантации поверхность этих устройств покрывается белками-хозяевами, которые обеспечивают хорошую поверхность для прикрепления бактерий и образования биопленок. Как только устройство инфицировано, оно должно быть полностью удалено, поскольку биопленка S. aureus не может быть разрушена антибиотиками.
Текущая терапия инфекций, опосредованных биопленкой S. aureus, включает хирургическое удаление инфицированного устройства с последующим введением антибиотика. лечение. Одно только обычное лечение антибиотиками неэффективно для искоренения таких инфекций. Альтернативой послеоперационного лечения антибиотиками является использование растворимых гранул сульфата кальция, содержащих антибиотики, которые имплантируются вместе с медицинским устройством. Эти гранулы могут высвобождать высокие дозы антибиотиков в желаемом месте для предотвращения начальной инфекции.
Новые методы лечения биопленки S. aureus, включающие наночастицы серебра, бактериофаги и антибиотики растительного происхождения. изучаются. Эти агенты продемонстрировали ингибирующее действие против S. aureus, встроенного в биопленки. Было обнаружено, что класс ферментов обладает способностью разрушать матрикс биопленки, поэтому их можно использовать в качестве агентов диспергирования биопленок в сочетании с антибиотиками.
S. aureus может выжить на собаках, кошках и лошадях и вызвать шмеля у кур. Некоторые считают, что собаки медицинских работников должны считаться значительным источником устойчивого к антибиотикам S. aureus, особенно во время вспышки. В исследовании 2008 года, проведенном Boost, O’Donoghue и James, было обнаружено, что около 90% S. aureus, колонизированных в домашних собаках, оказались устойчивыми по крайней мере к одному антибиотику. Носовая область считается наиболее важным местом передачи между собаками и людьми.
S. aureus является одним из возбудителей мастита у молочных коров. Его большая полисахаридная капсула защищает организм от распознавания иммунной защитой коровы.
S. aureus продуцирует различные ферменты, такие как коагулаза (связанные и свободные коагулазы), которая свертывает плазму и покрывает бактериальную клетку, вероятно, для предотвращения фагоцитоза. Гиалуронидаза (также известная как фактор распространения) расщепляет гиалуроновую кислоту и помогает в ее распространении. S. aureus также продуцирует дезоксирибонуклеазу, которая расщепляет ДНК, липазу для переваривания липидов, стафилокиназу для растворения фибрина и помощи в распространении и бета -лактамаза для устойчивости к лекарствам.
В зависимости от штамма S. aureus способен секретировать несколько экзотоксинов, которые можно разделить на три группы. Многие из этих токсинов связаны с определенными заболеваниями.
Список малых РНК, участвующих в контроль бактериальной вирулентности S. aureus усиливается. Этому могут способствовать такие факторы, как повышенное образование биопленок в присутствии повышенных уровней таких малых РНК. Например, RNAIII, SprD, SprC, RsaE, SprA1, SSR42, ArtR, SprX и Teg49 <553.>Стратегии посттранскрипционной регуляции 3'-нетранслируемой областью Многие мРНК в S. aureus несут три первичных нетранслируемыхобласти (3'UTR) длиннее 100 нуклеотидов, которые могут выполнять регуляторную функцию. Дальнейшее исследование мРНК icaR (мРНК, кодирующей репрессор основного эксполисахаридного соединения матрикса биопленки бактерий), что связывание 3'UTR к 5 'UTR может мешать комплексу инициации трансляции и генерировать двухступенчатый субстратный субстрат для РНКазы III. Взаимодействие происходит между мотивом UCCCCUG в 3'UTR и областью Шайн-Далагарно в 5'UTR. Делеция мотивация к накоплению репрессора IcaR и ингибирование развития биопленок. Образование биопленок является основной инфекцией имплантатов стафилококками. Биопленки - это группы микроорганизмов, как бактерии, которые прикрепляются друг к другу и растут на влажных поверхностях. Биопленка S. aureus высокой устойчивостью к лечению антибиотиками и иммунным ответом хозяина. Одна из гипотез, объясняющих это, заключается в том, что матрица биопленки защищает встроенные клетки, действуя как барьер, предотвращает проникновение антибиотиков. Однако матрица биопленки из множества различных каналов, поэтому эта гипотеза становится все менее вероятной, но матрица биопленки, возможно, содержит ферменты, расщепляющие антибиотики, такие как β-лактамазы, которые могут предотвратить проникновение антибиотиков. Другая гипотеза состоит в том, что условия в матрице биопленки способствуют образованию клеток-персистеров, которые являются высокоустойчивыми антибиотиками, спящими бактериальными клетками. Биопленки S. aureus также высокой устойчивостью к иммунному ответу хозяина. Хотя точный механизм неизвестен, биопленки S. aureus увеличивают рост в организме цитокинов, продуцируемых иммунным ответом хозяина. Антитела хозяина эффективны для биопленки S. aureus из-за гетерогенного распределения антигена, когда антиген может присутствовать в некоторых областях биопленки, но полностью отсутствовать в других областях. Белок A прикреплен к стафилококковому прикреплен к стафилококковому пептидогликану пентаглициновым мостикам (цепям из пяти остатков глицина ) с помощью транспептидазы сортировка А. Белок A, связывающий IgG белок, связывается с областью Fc антитела. Фактически, исследования, включающие мутацию генов, кодирующих белок А, приводят к снижению вирулентности S. aureus, измеренной по выживаемости в крови, что привело к предположению, что вирулентность, вызванная белком А, требует связывания Fc-области антитела. Белок А в различных рекомбинантных формах десятилетиями использовался для связывания и очистки широкого спектра антител с помощью иммуноаффинной хроматографии. Транспептидазы, такие как сорта, ответственные за закрепление факторов, таких как протеин А, на стафилококковом пептидогликане, изучаются в надежде на новые антибиотики для борьбы с инфекциями MRSA.Биопленка
Другое. иммуноэвазивные стратегии
 С. aureus на соевом агаре с триптиказой : штамм продуцирует желтый пигмент стафилоксантин.
С. aureus на соевом агаре с триптиказой : штамм продуцирует желтый пигмент стафилоксантин.
Некоторые штаммы S. aureus способны продуцировать стафилоксантин - золототистый пигмент. Этот пигмент действует как фактор вирулентности, прежде всего как бактериальный антиоксидант, который помогает микробам избежать активных форм кислорода, которые иммунная система хозяина использует для уничтожения патогенов..
Мутантные штаммы S. aureus, модифицированные для отсутствия стафилоксантина, с меньшей вероятностью выживут при инкубации окисляющим химическим веществом, таким как перекись водорода, чем пигментированные штаммы. Мутантные колонии быстро создают при воздействии нейтрофилов человека, в то время как многие из пигментированных колоний выживают. У мышей пигментированные штаммы вызывают затяжные абсцессы при попадании в раны, тогда как раны, инфицированные непигментированными штаммами, быстро заживают.
Эти тесты предполагают, что штаммы стафилококков используют стафилоксантин в качестве защиты нормальной иммунной системы человека. Лекарства, предназначенные для подавления производства стафилоксантина, могут ослабить бактерию и возобновить ее восприимчивость к антибиотикам. Фактически, из-за сходства путей биосинтеза стафилоксантина и человеческого холестерина было показано, что лекарство, разработанное в контексте терапии, снижающее уровень холестерина, блокирует пигментацию S. aureus и прогрессирование заболевания в модель инфекции у мышей.
 Типичные грамположительные кокки, кластеры, из образца мокроты, окраска по Граму
Типичные грамположительные кокки, кластеры, из образца мокроты, окраска по Граму В зависимости от типа присутствующей инфекции, соответствующий образец получают и отправляют в лабораторию для окончательной идентификации с помощью биохимических или ферментативных тестов. Сначала выполняется окраска по Граму, чтобы определить путь, который должен выявить типичные грамположительные бактерии, кокки, в скоплениях. Во-вторых, изолят культивируют на агаре с маннитовой солью, которая представляет собой селективную среду с 7–9% NaCl, которая позволяет S. aureus расти, образуя в результате колонии желтого цвета. ферментации маннита и последующего снижения содержания pH.
в среде того, для дифференциации на уровне каталаза (положительная для всех видов стафилококка), коагулаза (фибрин образование сгустка, положительный для S. aureus), ДНКаза (зона клиренса на ДНКазном агаре), липаза (желтый цвет и прогорклый запах), и фосфатаза (розовый цвет) все тесты выполнены. При стафилокковом пищевом отравлении можно выполнить фаговое типирование, чтобы определить, были ли стафилококки, выделенные из пищи, заражением.
Недавние действия и еда, проведенная недавно ел о съеденном, спрашивает врач, и проводится медицинский осмотр для проверки любых симптомов. При более серьезных симптомах можно провести анализ крови и посев кала. Лаборатории микробиологической диагностики и справочные лаборатории являются ключевыми для вспышек и новых штаммов S. aureus. Последние достижения в области позволили использовать надежные и быстрые методы идентификации и характеристики клинических изолятов S. aureus в режиме реального времени. Эти инструменты стратегии инфекционного контроля, распространение бактерий и обеспечение надлежащего использования антибиотиков. Количественная ПЦР все чаще используется для быстрой вспышек инфекции.
При наблюдении за развитием S. aureus и его способностью адаптироваться к каждому модифицированному антибиотику используются два основных метода, как известные «полосно-« на основе »или« на основе основы ». Имея в виду эти два метода, другие методы, такие как мультилокусное типирование следовать (MLST), гель-электрофорез в импульсном поле (PFGE), бактериофаговое типирование, spa-локус типизация и типизация SCCmec часто выполняются чаще других. С помощью этих методов можно определить, где произошли штаммы MRSA, а также они находятся в настоящее время.
В MLST этот метод типирования использует фрагменты нескольких генов домашнего хозяйства, известные как aroE, glpF, gmk, pta, tip и yqiL. Затем этим последовательностям присваивается номер, который соответствует строке из нескольких номеров, служащих аллельным профилем. Это распространенный метод, ограничивающий использование микроматрицы, который обнаруживает новые аллельные профили, что делает его дорогостоящим и трудоемким экспериментом.
С PFGE, метод, который еще очень много используется с момента его первого успеха в 1980-х годах, по-прежнему помогает дифференцировать изоляты MRSA. Для этого в методе используется многократный гель-электрофорез, а также градиент напряжения для отображения четкого разрешения молекул. Затем затем фрагменты S. aureus переходят вниз по гелю, создавая специфические полосы, которые позже сравнивают с другими изолятами в надежде идентифицировать родственные штаммы. Ограничения метода включают практические трудности с однородными диаграммами полос и чувствительностью PFGE в целом.
Типирование Spa-локуса также считается популярным методом, который использует единственную зону локуса в полиморфной области S. aureus для различения любых форм мутаций. Этот метод часто является недорогим и менее трудоемким, вероятность потери дискриминирующей способности, затрудняющая дифференциацию между клональными комплексами MLST, является одним из важнейших ограничений.
Лечением выбора для инфекции S. aureus пенициллин. Антибиотик, полученный из некоторых видов грибов Пенициллий , пенициллин ингибирует образование поперечных связей пептидогликана, которые обеспечивают жесткость и прочность стенки бактериальной клетки.. Четырехчленное β-лактамное кольцо пенициллина связано с ферментом DD-транспептидазой, фермент, который в функциональном состоянии выводит цепи пептидогликана, образующие стенки бактериальных клеток. Связывание β-лактама с DD-транспептидазой подавляет функциональность фермента и больше не может катализировать образование поперечных связей. В результате образование и деградация клеточной стенки нарушаются, что приводит к гибели клеток. Однако в большинстве стран резистентность к пенициллину является чрезвычайно распространенным явлением, и терапия первой линии чаще всего представляет собой устойчивый к пенициллиназе β-лактамный антибиотик (например, оксациллин или флуклоксациллин, оба из которых имеют тот же механизм действия, что и пенициллин). Комбинированная терапия с гентамицином может применяться для лечения серьезных инфекций, таких как эндокардит, но ее использование вызывает споры из-за высокого риска повреждения почек. Продолжительность лечения зависит от очага инфекции и степени тяжести. Дополнительный рифампицин исторически использовался для лечения бактериемии S aureus, но данные рандомизированных контролируемых исследований показали, что это не имеет общего преимущества по сравнению со стандартной терапией антибиотиками.
Устойчивость к антибиотикам у S. aureus была редкостью, когда пенициллин применялся. впервые представили в 1943 году. Действительно, в оригинальной чашке Петри, на которой Александр Флеминг из Имперский колледж Лондона наблюдал антибактериальную активность гриба Penicillium, выращивала культуру S. aureus. К 1950 г. 40% больничных изолятов S. aureus были устойчивыми к пенициллину; к 1960 году это число возросло до 80%.
MRSA, часто произносимое как или, является одним из многих опасались штаммов S. aureus, которые стали устойчивыми к большинству β-лактамных антибиотиков. По этой причине ванкомицин, гликопептидный антибиотик, обычно используется для борьбы с MRSA. Ванкомицин подавляет синтез пептидогликана, но, в отличие от β-лактамных антибиотиков, гликопептидные антибиотики связываются с аминокислотами в клеточной стенке, предотвращая образование поперечных связей пептидогликана. Штаммы MRSA чаще всего встречаются в таких учреждениях, как больницы, но они становятся все более распространенными при внебольничных инфекциях.
Незначительные кожные инфекции можно лечить мазью с тройным антибиотиком.
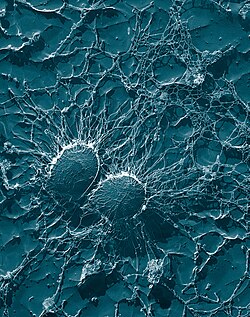 Бактериальные клетки S. aureus, который является одним из возбудителей мастита у дойных коров : его большая капсула защищает организм от атаки иммунологической защитой коровы.
Бактериальные клетки S. aureus, который является одним из возбудителей мастита у дойных коров : его большая капсула защищает организм от атаки иммунологической защитой коровы. Устойчивость к пенициллину стафилококков опосредуется выработкой пенициллиназы (форма бета-лактамазы ): фермент, который расщепляет кольцо β-лактама молекулы пенициллина, что делает антибиотик неэффективным. Пенициллиназарезистентные β-лактамные антибиотики, такие как метициллин, нафциллин, оксациллин, клоксациллин, диклоксациллин, и флуклоксациллин способны противостоять разложению под действием стафилококковой пенициллиназы.
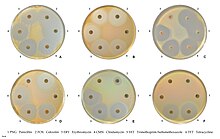 Восприимчивость к обычно используемым антибиотикам.
Восприимчивость к обычно используемым антибиотикам. Устойчивость к метициллину опосредуется через оперон mec , часть mec стафилококковой кассеты хромосомы (SCCmec). SCCmec - это семейство мобильных генетических элементов, которое является основной движущей силой эволюции S. aureus. Устойчивость обеспечивается геном mecA, который кодирует измененный пенициллин-связывающий белок (PBP2a или PBP2 '), который имеет более низкое сродство к связыванию β-лактамов (пенициллинов, цефалоспоринов, и карбапенемы ). Это обеспечивает устойчивость ко всем β-лактамным антибиотикам и исключает их клиническое применение при инфекциях MRSA. Исследования объяснили, что этот мобильный генетический элемент был приобретен разными линиями в ходе отдельных событий переноса генов, что указывает на отсутствие общего предка для разных штаммов MRSA.
Аминогликозидные антибиотики, такие как канамицин, гентамицин, стрептомицин когда-то были эффективны против стафилококковых инфекций до тех пор, пока у штаммов не выработались механизмы ингибирования действия аминогликозидов, которое происходит через протонированные аминовые и / или гидроксильные взаимодействия с рибосомная РНК бактериальной 30S рибосомной субъединицы. В настоящее время широко признаны три основных механизма механизмов устойчивости к аминогликозидам: ферменты, модифицирующие аминогликозиды, рибосомные мутации и активные отток лекарственные средства из бактерий.
Ферменты, модифицирующие аминогликозиды, инактивируют аминогликозид путем ковалентного присоединения фрагмента фосфата, нуклеотида или ацетила либо к амину, либо к спирту. ключевая функциональная группа (или обе группы) антибиотика. Это изменяет заряд или стерически мешает антибиотику, уменьшая его сродство к связыванию с рибосомами. У S. aureus наиболее охарактеризованным ферментом, модифицирующим аминогликозидом, является аминогликозид-аденилилтрансфераза 4 'IA (ANT (4') IA). Этот фермент был обнаружен методом рентгеновской кристаллографии. Фермент способен присоединять аденил фрагмент к 4-гидроксильной группе многих аминогликозидов, включая камамицин и гентамицин.
Устойчивость к гликопептидам опосредуется приобретением гена vanA, который происходит из транспозона Tn1546, обнаруживается в плазмиде в энтерокках, и кодирует фермент, который продуцирует альтернативный пептидогликан, с соответствующим ванкомицин не связывается.
Сегодня S. aureus стал устойчивым ко многим широко используемым антибиотикам. В Великобритании только 2% всех изолятов S. aureus чувствительны к пенициллину, с аналогичной картиной во всем мире. Пенициллины, устойчивые к β-лактамазам (метициллин, оксациллин, клоксациллин и флуклоксациллин) были разработаны для лечения устойчивых к пенициллину S. aureus и до сих пор используются в качестве препаратов первой линии. Метициллин был первым антибиотиком этого класса, который был использован (он представлен в 1959 году), но только два года спустя в Англии был зарегистрирован первый случай метициллин-резистентного золотистого стафилококка (MRSA).
Несмотря на это, Таким образом, MRSA обычно оставался необычным обнаружением даже в больничных условиях до 1990-х годов, когда распространенность MRSA в больницах резко возросла, и теперь он эндемичен.
Инфекции MRSA как в больницах, так и в общественных местах обычно лечатся с помощью не-β-антибиотики, такие как клиндамицин (линкозамин) и ко-тримоксазол (также широко известный как триметоприм / сульфаметоксазол ). Устойчивость к этому антибиотикам также привела к использованию новых анти-грамположительных антибиотиков широкого действия, таких как линезолид, из-за его доступности в качестве перорального препарата. В настоящее время лечением первой линии серьезных инвазивных инфекций, вызванных MRSA, являются антибиотики гликопептида (ванкомицин и тейкопланин ). Эти антибиотики недоступны, токсичность и необходимость регулярного контроля уровня лекарств с помощью анализов крови. Кроме того, гликопептидные антибиотики не очень хорошо проникают в инфицированные ткани (это особенно важно при инфекциях головного мозга и мозговых оболочек и при эндокардите ). Гликопептиды нельзя использовать для лечения метициллин-чувствительного S. aureus (MSSA), поскольку результаты хуже.
Из-за высокого уровня устойчивости к пенициллинам и из-за способности MRSA повышает устойчивость к ванкомицину, США Центры по контролю и профилактике заболеваний опубликовали рекомендации по надлежащему применению ванкомицина. В ситуациях, когда известно, что заболеваемость MRSA-инфекциями высока, лечащий врач может выбрать использование гликопептидного антибиотика до тех пор, пока не станет известна личность инфекционного организма. После подтверждения того, что инфекция вызвана метициллин-чувствительным штаммом S. aureus, лечение можно изменить на флуклоксациллин или даже пенициллин, в зависимости от ситуации.
Устойчивый к ванкомицину S. aureus (VRSA) представляет собой штамм S. aureus, который стал устойчивым к гликопептидам. Первый случай S. aureus промежуточного звена с ванкомицином (VISA) был зарегистрирован в Японии в 1996 г.; но о первом случае S. aureus, действительно к гликопептидным антибиотикам, было зарегистрировано только в 2002 году. По состоянию на 2005 год в США Штатах было зарегистрировано три случая инфекции VRSA. По крайней мере частично, устойчивость S. aureus к противомикробным препаратам можно объяснить тем, что его способность адаптироваться. Множественные двухкомпонентные пути передачи сигналов дают S. aureus экспрессировать гены, которые необходимы для выживания в условиях антимикробного стресса.
Около 33% населения США являются носителями S. aureus и примерно 2% переносят MRSA.
Носительство S. aureus является важным элементом внутрибольничной инфекции (также называемой нозокомиальной) и внебольничной инфекцией MRSA. S. aureus может присутствовать на коже хозяина, большая часть его носительства проходит через передние ноздри носовых ходов. Способность носовых ходов содержит S. aureus является результатом комбинации ослабленного или неполноценного иммунитета хозяина и бактерии бактерии уклоняться от врожденного иммунитета хозяина. Носительство через нос также вызывает возникновение инфекций стафилококка.
Распространение S. aureus (включая MRSA) обычно происходит через контакт между людьми, хотя в последнее время некоторые ветеринары обнаружили, что инфекция может передаваться через домашних животных, причем загрязнение окружающей среды, как считается, играет относительно менее важную роль. Акцент на основных методах мытья рук, таким образом, эффективен для предотвращения его передачи. Использование персоналом одноразовых фартуков и перчаток снижает контакт кожи с кожей, что дополнительно снижает риск передачи.
В последнее время в больницах по всей Америке зарегистрировано бесчисленное количество случаев S. aureus. Передача возбудителя облегчается в медицинских учреждениях, где уровень гигиены у медицинских работников недостаточен. S. aureus - невероятно выносливая бактерия, как было показано в исследовании, в котором она выживала на полиэстере чуть менее трех месяцев; Полиэстер является основным материалом, из которого изготавливаются занавески в больницах.
Бактерии переносятся через руки медицинских работников, которые могут забрать их от внешне здорового пациента, несущего доброкачественный или комменсальный штамм S. aureus, а затем передать его следующему пациенту, проходящему курс лечения. Попадание бактерий в кровоток может привести к различным осложнениям, включая эндокардит, менингит и, если он широко распространен, сепсис.
Этанол оказался эффективным местным дезинфицирующим средством против MRSA. Четвертичный аммоний можно использовать в сочетании с этанолом для увеличения продолжительности дезинфицирующего действия. Профилактика внутрибольничных инфекций включает плановую и окончательную очистку. Негорючие пары спирта в системах CO. 2 NAV-CO2 имеют преимущество, поскольку они не разрушают металлы или пластмассы, используемые в медицинских средах, и не способствуют антибактериальной устойчивости.
Важным и ранее неизвестным способом колонизации и передачи MRSA, связанных с сообществом, является половой контакт.
С. aureus погибает за одну минуту при 78 ° C и через десять минут при 64 ° C, но устойчив к замораживанию.
Некоторые штаммы S. aureus были описаны как устойчивые к дезинфекции хлором
Использование мази мупироцина может снизить частоту инфекций из-за носительства S. aureus через нос. Имеются ограниченные доказательства того, что декомпозиция носителей S. aureus с помощью антибиотиков или антисептиков может снизить частоту инфекций в области хирургического вмешательства.
| Самые распространенные бактерии в каждой отрасли | |
|---|---|
| Общественное питание промышленность | Vibrio parahaemolyticus, S. aureus, Bacillus cereus |
| Медицинская промышленность | Escherichia coli, S. aureus, Pseudomonas aeruginosa |
По состоянию на 2015 год, одобренной вакцины против S. aureus не существует. Ранние клинические испытания были проведены для нескольких вакцин-кандидатов, таких как StaphVax от Nabi и PentaStaph, Intercell / Merck V710, VRi SA75 и др.
В то время как некоторые из этих вакцин-кандидатов показали иммунный ответ, другие усугубили инфекцию, вызванную S. aureus. На сегодняшний день ни один из этих кандидатов не обеспечивает защиты от инфекции S. aureus. Разработка StaphVax от Наби была остановлена в 2005 году после того, как испытания III фазы оказались неудачными. Первый вариант вакцины Intercell V710 был прекращен во время фазы II / III после того, как среди пациентов, у которых развилась инфекция S. aureus, наблюдались более высокие показатели смертности и заболеваемости.
Кандидат в вакцины PentaStaph с усиленной вакциной против S. Текущий статус PentaStaph неясен. Документ ВОЗ указывает, что PentaStaph не удалось пройти стадию испытания III фазы.
В 2010 г. GlaxoSmithKline начал фазу 1 слепым методом. исследование для оценки вакцины GSK2392103A. По состоянию на 2016 год эта вакцина больше не находится в стадии активной разработки.
Pfizer S. Вакцина SA4Ag с четырьмя антигенами aureus получила ускоренное обозначение Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в феврале 2014 года. Результаты фазы 1, опубликованные в феврале 2017 года, показали очень надежную и безопасную иммуногенность SA4Ag.
В 2015 году компания Novartis Vaccines and Diagnostics, бывшее подразделение Novartis, а теперь входящая в состав GlaxoSmithKline, опубликовала многообещающие доклинические результаты их четырехкомпонентной вакцины Staphylococcus aureus, 4C-staph.
| Классификация | D |
|---|
| Викискладе есть медиафайлы, связанные с Staphylococcus aureus. |
| Wikispecies содержит информацию, относящуюся к Staphylococcus aureus |