Семейство предшественников микроРНК mir-26 - mir-26 microRNA precursor family
редактировать
Содержание
- 1 Происхождение
- 2 выражения
- 3 роли miR-26a
- 4 роли miR-26b
- 5 Ссылки
- 6 Дополнительная литература
- 7 Внешние ссылки
Происхождение
микроРНК miR-26 представляет собой небольшую некодирующую РНК, которая участвует в регуляции экспрессии гена. Семейство miR-26 состоит из miR-26a-1, miR-26a-2 и miR-26b, расположенных в хромосомах 3, 12 и 2, соответственно. Pre-miR-26 со структурой «стержень-петля» процессируется в зрелую miR-26 с помощью ряда ферментов внутриядерной и внутрицитоплазмы. Зрелая miRNA miR-26a-1 и miR-26a-2 обладает одинаковой последовательностью, за исключением двух разных нуклеотидов в зрелой miR-26b. miR-26, по-видимому, представляет собой позвоночных специфичных микроРНК, и теперь она предсказана или экспериментально подтверждена у многих видов позвоночных (MIPF0000043 ).
Экспрессии
Экспрессия miR-26 индуцируется в ответ на гипоксию и активируется во время дифференцировки гладкомышечных клеток (SMC) и нейрогенеза.. Более того, miR-26 постоянно подавляется в широком диапазоне злокачественных опухолей, таких как гепатоцеллюлярная карцинома, карцинома носоглотки, рак легких и рак груди. Напротив, miR-26a сверхэкспрессируется в глиоме высокой степени и холангиокарциноме. О повышенной экспрессии miR-26b сообщалось при опухоли гипофиза и раке мочевого пузыря. miR-26 становится критическими регуляторами канцерогенеза и прогрессирования опухоли, действуя либо как онкогены, либо как гены-супрессоры опухоли при различных раковых заболеваниях.
роли miR-26a
- Дифференцировка гладкомышечных клеток (SMC)
- miRNA-26a значительно усиливается во время дифференцировки SMC и подавляется при аневризме брюшной аорты (AAA) формирование. Ингибирование miRNA-26a ускоряет дифференцировку SMC, а также способствует апоптозу, подавляя пролиферацию и миграцию. Сверхэкспрессия miRNA-26a подавляет дифференцировку. МикроРНК-26a нацелена на экспрессию SMAD-1 и SMAD-4, членов сигнального каскада TGF-β суперсемейства. Ингибирование miRNA-26a увеличивает экспрессию генов SMAD-1 и SMAD-4, в то время как сверхэкспрессия подавляет SMAD-1.
- Гепатоцеллюлярная карцинома
- miR-26a вызывает остановку клеточного цикла в фазе G1 в клетках гепатоцеллюлярной карциномы человека, частично за счет прямого подавления циклина D2 и циклина E 2. miR-26a также напрямую подавляет экспрессию рецептора эстрогена альфа (Erα). Сверхэкспрессия miR-26a вызывает негативную регуляцию как пролиферации клеток, так и клеточного цикла. Терапевтическая доставка miR-26a с использованием аденоассоциированного вируса (AAV) способна ингибировать образование раковых клеток, а также индуцировать опухолеспецифический апоптоз и обеспечивать драматическую защиту от прогрессирования заболевания без токсичности.
- Карцинома носоглотки
- miR-26a обычно подавляется в образцах карциномы носоглотки и клеточных линиях. Он непосредственно подавляет экспрессию онкогена EZH2 (усилитель гомолога 2 zeste), что, в свою очередь, вызывает ингибирование роста клеток и прогрессирования клеточного цикла. miR-26a снова подавляет туморогенез в клетках носоглотки in vivo, с подавлением экспрессии c-myc, циклинов D3 и E2 и циклин-зависимых киназы CDK4 и CDK6. Экспрессия ингибиторов CDK p14 и p21, наоборот, усиливается, в основном за счет экспрессии EZH2.
- Рак молочной железы
- В образцах и клеточных линиях рака молочной железы наблюдается подавление miR-26a, и было показано, что он функционально противодействует человеческой груди канцерогенез. miR-26a напрямую регулирует экспрессию метадгерина (MTDH) и EZH2. Он также вызывает апоптоз, ингибирование образования колоний и туморогенез клеток рака груди in vivo. Было показано, что снижение экспрессии MTDH и EZH2 сопровождается увеличением апоптоза, тогда как повторная экспрессия MTDH частично отменяет проапоптотический эффект miR-26a.
- Рак легкого
- miR-26a играет важную роль как антионкоген в молекулярном механизме рака легких человека. Экспрессия miR-26a подавляется в тканях рака легких человека по сравнению с нормальными тканями. Между тем, сверхэкспрессия miR-26a в линии клеток рака легкого человека A549 резко ингибирует пролиферацию клеток, блокирует фазовый переход G1 / S, индуцирует апоптоз и подавляет метастазирование и инвазию клеток in vitro. Усилитель гомолога 2 zeste (EZH2) представляет собой a. потенциальная мишень для miR-26a.
- Глиома
- miR-26a может служить онкогеном в канцерогенезе глиомы. Было обнаружено, что он сверхэкспрессируется в подмножестве глиом высокой степени злокачественности и напрямую нацелен на транскрипт PTEN. Сверхэкспрессия miR-26a в глиоме в основном является результатом амплификации в локусе miR-26a-2, геномного события, сильно связанного с потерей моноаллельного PTEN. MiR-26a-опосредованная репрессия PTEN в модели глиомы на мышах как усиливает образование опухоли de novo, так и предотвращает потеря гетерозиготности и локуса PTEN.
- Лимфома Беркитта
- miR-26a играет роль потенциального опухолевого супрессора в лимфоме, индуцированной MYC. Обнаружено, что miR-26a подавляется в первичных клеточных линиях лимфомы Беркитта человека и MYC-зависимых клеточных линиях лимфомы. Эктопическая экспрессия miR-26a влияет на развитие клеточного цикла, нацеливаясь на настоящий онкоген EZH2, который является белком polycomb и глобальным регулятором экспрессии генов. MYC модулирует гены, важные для онкогенеза, посредством дерегуляции miRNAs, miR-26a, способствует лимфомагенезу, управляемому MYC.
- Холангиокарцинома человека
- miR-26a способствует росту холангиокарциномы путем ингибирование GSK-3β и последующая активация β-катенина. Ткани и клеточные линии холангиокарциномы человека имеют повышенные уровни miR-26a по сравнению с доброкачественными билиарными эпителиальными клетками. Сверхэкспрессия miR-26a увеличивает пролиферацию клеток холангиокарциномы и образование колоний in vitro, тогда как истощение miR-26 снижает эти параметры. Сверхэкспрессия miR-26a клетками холангиокарциномы увеличивает рост опухоли у мышей с тяжелым комбинированным иммунодефицитом. МРНК GSK-3β является прямой мишенью для miR-26a, опосредованное miR-26a восстановление GSK-3β приводит к активации β-катенина и индукции нескольких нижестоящих генов, включая c-Myc, cyclinD1 и рецептор, активируемый пролифератором пероксисом δ. Истощение β-катенина частично предотвращает индуцированную miR-26a пролиферацию опухолевых клеток и образование колоний.
- Меланома
- Замена miR-26a предлагается в качестве потенциальной терапевтической стратегии для метастатической меланомы. mir-26a сильно подавляется в клетках меланомы по сравнению с первичными меланоцитами. Обработка клеточных линий меланомы миметиком miR-26a способствует значительной и быстрой гибели в результате апоптоза. Предполагается, что mir-26a способствует этому апоптозу путем подавления экспрессии белка BAG4 / Silencer of Death Domains (SODD) посредством связывания 3'UTR SODD. [1
роли miR-26b
- Гипоксия
- miR-26 участвует в ответах на низкие уровни кислорода и, как было показано, подавляет апоптоз клеток в условиях гипоксии. Предлагаемый механизм для этого - прямое нацеливание на проапоптотический белок BAK1 с помощью miR-26.
- Нейрональная дифференцировка
- Экспрессия генов, которые после активации индуцируют дифференцировку нервных стволовых клеток в нейроны подавляются группой фосфатаз, известной как малые фосфатазы карбоксиконцевого домена полимеразы II (CTDSP). Наряду с другими фосфатазами CTDSP составляют важные компоненты белкового комплекса REST (фактор транскрипции, подавляющий репрессор 1) / NRSF (фактор, ограничивающий нейроны, глушитель). Этот комплекс REST / NRSF контролирует активацию генов, в свою очередь ответственных за контроль дифференцировки нервных стволовых клеток. Было обнаружено, что miR-26b, кодируемая в интроне первичного транскрипта CTDSP2 , нацеливается и подавляет экспрессию CTDSP2. Генерация зрелой miR-26b активируется во время нейрогенеза, и существует неактивная петля отрицательной обратной связи между miR-26b и CTDSP2 в нейрональных стволовых клетках с ингибированием miR-26b на уровне предшественника.
- Гепатоцеллюлярная карцинома
- miR -26a / b действуют синергетически со своими генами-хозяевами, CTDSPL, CTDSP2 и CTDSP1, чтобы блокировать переход G1 / S путем активации pRb белок в клетках рака печени HepG2 и HuH7. Пациенты, опухоли которых имеют низкую экспрессию miR-26, имеют более короткую общую выживаемость, но лучший ответ на терапию интерфероном α, чем пациенты, опухоли которых имеют высокую экспрессию микроРНК.
- Клетки носоглоточного эпителия (CNE)
- miR-26b подавляется более чем в 38 раз в клетках карциномы носоглоточного эпителия (CNE) в условиях гипоксии, индуцированной десфериоксамином (DFOM). Уровни экспрессии miR-26b и COX-2 белка обратно коррелированы в DFOM-обработанных клетках CNE. Сверхэкспрессия miR-26b в DFOM-обработанных CNE-клетках ингибирует пролиферацию клеток посредством нацеливания на COX-2.
- Рак молочной железы
- miR-26b играет защитную роль в молекулярном Этиология рака молочной железы человека за счет содействия апоптозу. Экспрессия miR-26b снижена при раке груди человека и семи клеточных линиях рака молочной железы человека, MCF7, MDA-MB-231, MDA-MB-468, MDA-MB-453, BT-549 и. Сверхэкспрессия miR-26b снижает жизнеспособность и запускает апоптоз клеток MCF7 рака груди человека. SLC7A11 идентифицирован как прямая мишень для miR-26b, и его экспрессия заметно повышена как в клеточных линиях рака молочной железы, так и в клинических образцах.
- Колоректальный рак
- Экспрессия miR-26b значительно снижена в клетках линии эмбриональных стволовых клеток и клеток линии клеток колоректального рака (CRC) по сравнению с другими тремя линиями колоректальных клеток, HT29 и Caco-2. Сверхэкспрессия экспрессии miR-26b с помощью трансфекции, имитирующей miR-26, приводит к значительному подавлению роста клеток и индукции апоптоза в клетках LoVo in vitro и ингибированию роста опухоли in vivo. Четыре гена (TAF12, PTP4A1, CHFR и ALS2CR2) с пересечением являются мишенями miR-26b. Регуляторные пути miR-26b в значительной степени связаны с инвазивностью и метастазированием клеток CRC.
- Глиома
- miR-26b может действовать как опухолевый супрессор в глиома. Низкий уровень экспрессии miR-26b обнаружен в клетках глиомы. Уровень miR-26b обратно коррелирует со степенью глиомы. EphA2 является прямой мишенью для miR-26b. Сверхэкспрессия miR-26b в клетках глиомы подавляет эндогенный уровень белка EphA2. Эктопическая экспрессия miR-26b подавляет пролиферацию, миграцию, инвазию и васкулогенную мимикрию клеток глиомы человека.
- Было обнаружено, что опухоли гипофиза, продуцирующие гормон роста (GH)
- miR-26b непосредственно нацелены и регулируют экспрессию гена-супрессора опухоли PTEN, мутации которого приводят к активации сигнального пути PI3K / AKT, увеличению выживаемости клеток и началу онкогенеза. Регулирование PTEN с помощью miR-26b обнаруживает прямые эффекты miR-26b на опухолевое поведение клеток гипофиза, при этом ингибирование miR-26b подавляет рост опухоли гипофиза в ксенотрансплантатах. Другая микроРНК, предшественник микроРНК miR-128 | miR-128, регулирует экспрессию гена BMI1, который подавляет уровни экспрессии PTEN, связываясь с его промоторной областью. Ингибирование экспрессии miR-26b наряду с повышающей регуляцией miR-128 подавляет колониеобразующую способность и инвазивность опухолевых клеток гипофиза.
Ссылки
Дополнительная литература
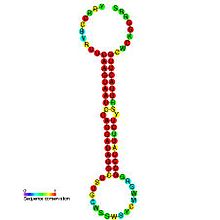 Предсказанная вторичная структура и последовательность сохранение идентификаторов mir-26
Предсказанная вторичная структура и последовательность сохранение идентификаторов mir-26