| Рак мочевого пузыря | |
|---|---|
 | |
| Переходно-клеточная карцинома мочевого пузыря. Белый цвет в мочевом пузыре контрастирует. | |
| Специальность | Онкология, урология |
| Симптомы | Кровь в моче, боль при мочеиспускании |
| Обычное начало | От 65 до 84 лет |
| Типы | Переходно-клеточная карцинома, плоскоклеточная карцинома, аденокарцинома |
| Факторы риска | Курение, семейный анамнез, предшествующая , частые инфекции мочевого пузыря, некоторые химические вещества |
| Метод диагностики | Цистоскопия с биопсией ткани |
| Лечение | Хирургия, лучевая терапия, химиотерапия, иммунотерапия |
| Прогноз | Пятилетняя выживаемость ~ 77% (США) |
| Частота | 549 000 новых случаев (2018) |
| Смерти | 200 000 (2018) |
Рак мочевого пузыря - это любой из нескольких типов рака, возникших в результате ткани мочевого пузыря. Симптомы включают кровь в моче, боль при мочеиспускании и боль в пояснице.
Факторы рака мочевого пузыря включают курение, семейный анамнез., предшествующая лучевая терапия, частые инфекции мочевого пузыря и химических веществ. Наиболее распространенный тип - переходно-клеточная карцинома. Другие типы включают плоскоклеточную карциную и аденокарциному. Диагноз обычно ставится на основании цистоскопии с биопсией ткани. Стадия рака определяется с помощью трансуретральной резекции и медицинской визуализации.
. Лечение зависит от стадии рака. Он может пойти некоторую комбинацию хирургического вмешательства, лучевой терапии, химиотерапии или иммунотерапии. Хирургические варианты могут трансуретральную резекцию, частичное или полное удаление мочевого пузыря или отведение мочи. Типичная пятилетняя выживаемость в США составляет 77%, в Канаде - 75%, в Европе - 68%.
Раком мочевого пузыря, по состоянию на 2018 год, пострадало около 1,6 миллиона человек. во всем мире - 549 000 новых случаев заболевания и 200 000 смертей. Возраст начала заболевания чаще всего составляет от 65 до 84 лет. Мужчины болеют чаще, чем женщины. В 2018 году самый высокий уровень заболеваемости раком мочевого пузыря был зарегистрирован в Южной Америке с показателями 15, 13 и 12 случаев на 100000 человек. Самые высокие показатели смертности от рака мочевого пузыря наблюдались в Северной Европе в Европе.
 Местоположение рака мочевого пузыря
Местоположение рака мочевого пузыря Мочевой пузырь r обычно рак вызывает кровь в моче, которую также можно увидеть или увидеть только под микроскопом. Кровь в моче является наиболее частым симптомом рака мочевого пузыря и протекает безболезненно. Видимая кровь в моче может быть кратковременной, и может потребоваться анализ мочи для подтверждения невидимой крови. От 80 до 90% людей с раком мочевого пузыря изначально имели видимую кровь. Кровь в моче также может быть вызвана другими состояниями, такими как камни мочевого пузыря или мочеточника, инфекция, заболевание почек, рак почек или сосудистые мальформации, хотя эти состояния (кроме рака почки ) обычно бывают болезненными.
Другие возможные симптомы включают боль при мочеиспускании, частое мочеиспускание или ощущение в потребности мочеиспускании без возможности сделать это. Эти признаки и симптомы неспецифичны для рака мочевого пузыря, а также могут быть вызваны незлокачественными состояниями, включая инфекции простаты, гиперактивный мочевой пузырь или цистит. Некоторые редкие формы рака мочевого пузыря, такие как урахальная аденокарцинома, продуцируют муцин, который выводится с мочой, делая ее густой.
У людей с запущенным заболеванием могут быть тазовые органы. или костная боль, нижняя конечность отек, или боль в боку. В редких случаях при физикальном осмотре можно построить пальпируемое образование.
Табак курение - основной фактор, способствующий развитию рака мочевого пузыря; в большинстве групп населения курение связано с более чем половиной случаев рака мочевого пузыря у мужчин и одной третью случаев у женщин, однако эти пропорции уменьшились за последние годы, поскольку в Европе и Северной Америке курильщиков меньше. Существует почти линейная зависимость между продолжительностью курения (в годах), лет на упаковку и риском рака мочевого пузыря. Можно вести плато риска при выкуривании около 15 сигарет в день (это означает, что те, кто выкуривает 15 сигарет в день, подвергаются примерно такому же риску, как и те, кто выкуривает 30 в день). Курение (сигары, трубки, египетские кальяны и бездымный табак) в любом увеличении риска рака мочевого пузыря. Отказ от курения снижает риск. Риск рака мочевого пузыря снижается на 30% в течение 1–4 лет и продолжает снижаться на 60% через 25 лет после отказа от курения. Однако бывшие курильщики, скорее всего, всегда будут подвержены более высокому риску рака мочевого пузыря по сравнению с людьми, которые никогда не курили. Пассивное курение также представляет собой риск.
Употребление опиума увеличивает риск рака мочевого пузыря в 3 раза, а одновременное употребление опиума и курения увеличивает риск рака мочевого пузыря в 5 раз по с населением в целом.
Тридцать процентов опухолей мочевого пузыря, вероятно, возникают в результате воздействия канцерогенов на рабочем месте. Профессиональное или косвенное воздействие считается причиной рака мочевого пузыря; бензидин (производство красителей), 4-аминобифенил (резиновая промышленность), 2-нафтиламин (производство азокрасителей, литейный дым, резиновая промышленность, сигаретный дым и рак исследования), фенацетин (анальгетик), мышьяк и хлорированные алифатические углеводороды в питьевой воде, аурамин (производство красителей), пурпурный (краситель производство), орто-толуидин (производство красителей), эпоксидные и полиуретановые отвердители (промышленность пластмасс), хлорнафазин, каменноугольный пек. Риску подвержены водителям автобусов, резиновые рабочие, маляры, механики, кожевники (включая сапожники), кузнецы, наладчики станков и механики. Считается, что парикмахеры также подвержены риску из-за того, что они часто подвергаются воздействию стойких красок для волос.
Инфекция Schistosoma haematobium (бильгарция или шистосомоз ) может вызвать рак мочевого пузыря., особенно плоскоклеточного типа. Яйца шистосомы вызывают хроническое воспалительное состояние в стенке мочевого пузыря, приводящее к фиброзу тканей. Более высокие уровни соединений N-нитрозо были обнаружены в образцах мочи людей с шистосомозом. Соединения N-нитрозо вовлечены в патогенез рака мочевого пузыря, связанного с шистосомозом. Они вызывают повреждение ДНК-алкилирования, особенно переходные мутации гуанина в аденина в HRAS и p53 ген -супрессор опухоли. Мутации p53 обнаруживаются в 73% опухолей, мутации BCL-2 составляют 32%, а комбинация этих двух составляет 13%. Другие причины плоскоклеточного рака мочевого пузыря включают хроническую катетеризацию у людей с повреждением спинного мозга и лечение циклофосфамидом в анамнезе.
Проглатывание аристолохика кислота, присутствующая во многих китайских лекарственных травах, вызывает уротелиальную карциному и почечную недостаточность. Аристолоховая кислота активирует пероксидазу в уротелии и вызывает мутацию трансверсии в гене TP53 опухолевого супрессора .
Люди, которые проходят дистанционную лучевую терапию (ДЛТ) по поводу рака простаты, имеют более высокий риск развития инвазивного рака мочевого пузыря.
Помимо основных факторов, существует множество других, которые можно изменить. факторы, которые менее сильно (т. е. увеличение риска на 10–20%) связаны с раком мочевого пузыря, например, ожирение. Хотя это можно рассматривать как второстепенные эффекты, снижение риска в общей популяции все же может быть достигнуто за счет уменьшения распространенности ряда меньших факторов риска.
Мутации в FGFR3, TP53, PIK3CA, KDM6A, ARID1A, KMT2D, HRAS, TERT, KRAS, CREBBP, RB1 и TSC1 гены могут быть связаны с некоторыми случаями Рак мочевого пузыря. Делеции частей или всей хромосомы 9 часто встречаются при раке мочевого пузыря. Известно, что рак низкого качества злокачественности содержит мутации в пути RAS и гене рецептора 3 фактора роста фибробластов (FGFR3), оба из которых играют роль в пути MAPK / ERK. Мутации генов p53 и RB вовлечены в развитие мышечно-инвазивных опухолей высокой степени злокачественности. Восемь девять процентов мышечно-инвазивного рака имеют мутации в генах ремоделирования хроматина и гистоновых модификаторов. Делеция обеих копий гена GSTM1 имеет умеренное увеличение риска рака мочевого пузыря. Продукт гена GSTM1 глутатион S-трансфераза M1 (GSTM1) участвует в процессе детоксикации канцерогенов, таких как полициклические ароматические углеводороды, обнаруженные в сигаретном дыме. Точно так же мутации в NAT2 (N-ацетилтрансфераза ) связаны с повышенным риском рака мочевого пузыря. N-ацетилтрансфераза помогает в детоксикации канцерогенов, таких как ароматические амины (также присутствующие в сигаретном дыме). Было показано, что различные однонуклеотидные полиморфизмы в гене PSCA, присутствующем на хромосоме 8, увеличивают риск рака мочевого пузыря. Область промотора гена PSCA имеет область ответа андрогена. Утрата реактивности этой области к андрогенам гипотетически является причиной большего количества агрессивных опухолей у женщин (в отличие от мужчин, у больше андрогенов).
Мышечно-инвазивный рак мочевого пузыря неоднороден по своей природе. В целом их можно генетически разделить на базальный и просветный подтипы. Базальный подтип показывает изменения с участием RB и NFE2L2, а люминальный показывает изменения в генах FGFR3 и KDM6A. Базальный подтип подразделяется на базовую группу клаудина низкого типа и агрессивен и показывает метастазы при поступлении, однако они реагируют на химиотерапию на основе платины. Люминальный подтип можно разделить на р53-подобный и люминальный. p53-подобные опухоли люминального подтипа, хотя и не такие агрессивные, как проявляют устойчивость к химиотерапии
 Утолщение стенки мочевого пузыря из-за рака
Утолщение стенки мочевого пузыря из-за рака  Опухоль мочевого пузыря в FDG PET из- за высокого физиологического ФДГ- в мочевом пузыре, фуросемид доставлся вместе с 200 МБк ФДГ. Захват краниально к поражению - это физиологический захват в толстой кишке.
Опухоль мочевого пузыря в FDG PET из- за высокого физиологического ФДГ- в мочевом пузыре, фуросемид доставлся вместе с 200 МБк ФДГ. Захват краниально к поражению - это физиологический захват в толстой кишке. В настоящее время лучший диагноз состояния мочевого пузыря - с помощью цистоскопии, которая представляет собой основу, при которой гибкая или жесткая трубка (называемая цистоскопом) с камерой и различными инструментами вводится в мочевой пузырь через уретру. Гибкая процедура позволяет проводить визуальный осмотр мочевого пузыря, выполнять незначительные восстановительные работы и брать образцы подозрительных поражений для биопсии. Жесткийстоскоп используется под общей анестезией в штатах и биопсии, а также при более обширном удалении опухоли. В от сосочкового поражения, которое прорастает в полость, мочевого пузыря и легко просматривается, карцинома in situ является плоской и неясной. Выявление карциномы in situ требует проведения нескольких биопсий из разных областей внутренней стенки мочевого пузыря. Фотодинамическое обнаружение (цистоскопия в синем свете) может помочь в обнаружении карциномы in situ. При фотодинамическом обнаружении краситель вводится в мочевой пузырь с помощью катетера. Раковые клетки поглощают визуальные подсказки, вызывающие биопсии или резекции.
Тестирование в любой форме, перечисленной выше, уязвимости для патологической классификации, типа клеток или стадия данной опухоли. Так называемой биопсии из холодной чашки во время обычной цистоскопии (жесткой или гибкой) также будет недостаточно для определения стадии патологии. Следовательно, после визуального обнаружения необходимо провести трансуретральную операцию. Процедура называется трансуретральной резекцией опухоли мочевого пузыря (ТУРМТ). Кроме того, до и после ТУР следует провести ректальное и вагинальное бимануальное исследование, чтобы определить, есть ли пальпируемое образование или опухоль зафиксировано («привязана») к стенке таза. Патологическая классификация и информация о стадиях, полученная с помощью процедуры TURBT, имеют фундаментальное значение для правильного выбора последующего лечения и / или режима последующего наблюдения.
Если инвазивный или тяжелый (включает карциному) in situ ) рак выявляется при ТУР, МРТ и / или КТ брюшной полости и таза или урограмме и КТ грудной клетки или рентген исследование грудной клетки для определения стадии заболевания и распространения распространения (метастаз ). Повышение уровня щелочной фосфатазы без признаков заболевания печени следует оценивать на предмет метастазов в кости с помощью сканирования костей. Хотя F-фтордезоксиглюкоза (ФДГ) -позитронно-эмиссионная томография (ПЭТ) КТ была исследована как жизнеспособный метод определения стадии, нет единого мнения, подтверждающего ее роль в рутинных клинических исследованиях.
Цитология мочи может быть получен с мочой или во время цистоскопии («промывание мочевого пузыря»). Цитология не очень чувствительна к опухолям низкой степени качества или степени 1 (отрицательный результат не может надежно исключить рак мочевого пузыря), но имеет высокую специфичность (положительный результат надежно обнаруживает рак мочевого пузыря). В качестве вспомогательных средств в диагностике рака мочевогоря доступны новые неинвазивные маркеры связывания с мочой, включая белок, связанный с человеческим фактор комплемента H, высокомолекулярный карциноэмбриональный антиген пузырчатый и ядерный матричный белок 22 (NMP22). В наших Штатах FDA одобрило тесты NMP22, NMP22 BladderChek и UroVysion для обнаружения и наблюдения за раком мочевого пузыря, а тесты ImmunoCyt, BTA-TRAK и BTA-STAT были одобрены только для наблюдения. BTA-STAT и BladderChek могут быть в клинике, а другие - в лаборатории. Другие неинвазивные тесты на основе мочи включают CertNDx анализ рака мочевого пузыря, который выявляет мутацию FGFR3, и тест на рак мочевого пузыря (UBC), который представляет собой сэндвич ELISA для Цитокератин 8 / 18 фрагмент. Аналогичным образом, NMP22 представляет собой сэндвич ELISA, а NMP22 BladderChek представляет собой индикаторную полоску иммуноанализа, оба они обнаруживают белок ядерного митотического аппарата (NuMA) опухолевый маркер (тип белка ядерного матрикса). UroVysion - это флуоресцентная гибридизация in situ, которая обнаруживает анеуплоидию в хромосомах 3, 7, 17 и потерю локуса 9p21. ImmunoCyt - это тест иммунофлуоресценции, который выявляет гликозилированные CEA и MUCIN -подобные антигены (M344, LDQ10, 19A11). BTA-STAT представляет собой индикаторную полоску иммуноанализа для обнаружения белка, родственного человеческому фактору комплемента H. BTA-TRAK представляет собой сэндвич ELISA, который также определяет белок, связанный с фактором комплемента Н. человека. Чувствительность по биомаркерам различировалась от 0,57 до 0,82, а специфичность от 0,74 до 0,88. Биомаркеры показали лучшие результаты при использовании в сочетании с цитологическим исследованием мочи, чем при использовании по отдельной. Тем не менее, возможны случаи низкой злокачественности, и 10% случаев рака все еще не учитываются. Текущие руководства не рекомендуют использовать биомаркеры мочи для обнаружения и наблюдения.
 Гистопатология уротелиальной карциномы мочевого пузыря. Трансуретральная биопсия. Окраска HE
Гистопатология уротелиальной карциномы мочевого пузыря. Трансуретральная биопсия. Окраска HE | Тип | Относительная частота | Подтипы |
|---|---|---|
| Переходно-клеточная карцинома | 95% | Папиллярный (70%) |
| Непапиллярный ( 30%) | ||
| Непереходно-клеточная карцинома | 5% | Плоскоклеточная карцинома, аденокарцинома, саркома, мелкоклеточная карциномы и вторичные отложения от рака в других частях тела. |
Непапиллярная карцинома включает карциному in situ (CIS), микроинвазивную карциному и откровенно инвазивную карциному. Карцинома in situ (CIS) неизменно состоит из цитологически высокосортных опухолевых клеток.
Переходно-клеточная карцинома может подвергаться дифференцировке (25%) на свои варианты. При рассмотрении под микроскопом папиллярная переходно-клеточная карцинома может проявляться в своей типичной форме или как одна из ее разновидностей (плоскоклеточный, железистая дифференцировка или микропапиллярный вариант). Ниже перечислены различные варианты непапиллярной переходно-клеточной карциномы.
| Вариант | Гистология | Процент непапиллярных случаев | Последствия |
|---|---|---|---|
| Плоскостная дифференцировка | Наличие межклеточных мостиков или кератинизации | 60% | Результаты, аналогичные обычному переходно-клеточному раку |
| Железистая дифференцировка | Наличие истинных железистых пространств | 10% | |
| Саркоматоидные очаги | Наличие как эпителиальной, так и мезенхимальной дифференцировки | 7% | Клинически агрессивный |
| Микропапиллярный вариант | Напоминает папиллярную серозную карциному яичника или напоминает микропапиллярную карциному груди или легкого | 3.7% | Клинически агрессивная, рекомендуется ранняя цистэктомия |
| Уротелиальная карцинома с небольшими канальцами и микрокистозной формой | Наличие кист размером от микроскопических до 1-2 мм | Редкая | |
| лимфоэпителиомоподобная карцинома | Напоминает лимфоэпителиому носоглотки | ||
| лимфомоподобные и плазмоцитоидн ые варианты | Злокачественные клетки r сходные клетки злокачественной лимфомы или плазмоцитомы | ||
| Вложенный вариант | Гистологически похожи на гнезда фон Брунна | Могут быть ошибочно признаны доброкачественными гнездами фон Брунна или не -инвазивная папиллярная уротелиальная карцинома низкой степени злокачественности | |
| Уротелиальная карцинома с гигантскими клетками | Наличие гигантских клеток эпителиальной опухоли и внешне похожа на гигантоклеточную карциному легкому | ||
| Трофобластическая дифференцировка | Наличие синцитиотрофобластных гигантских клеток или хориокарциноматозная дифференцировка ХГЧ | ||
| Вариант светлых клеток | Структура светлых клеток с богатым гликогеном цитоплазмой | ||
| Плазмоцитоид | Клетки с обильным содержанием липидов, имитирующая аденокарцинома из перстневых клеток желудка / дольчатого рака молочной железы | Клинически агрессивна, склонность к перитонеальному распр остранению | |
| Необычные стромальные реакции | Наличие следующих; псевдосаркоматозная строма, стромальная костная или хрящевая метаплазия, гигантские клетки типа остеокластов, лимфоидный инфильтрат |
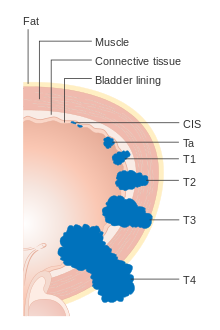 Диаграмма, показывающая стадия T рака мочевого пузыря
Диаграмма, показывающая стадия T рака мочевого пузыря  Рак мочевого пузыря N1
Рак мочевого пузыря N1  Расширенный пузырчатый пузырь рак (M1b)
Расширенный пузырчатый пузырь рак (M1b)  Лимфатические узлы в тазу. Рак мочевого пузыря обычно распространяется на запирательную клетку и внутреннюю подвздошную кость (не маркируется)
Лимфатические узлы в тазу. Рак мочевого пузыря обычно распространяется на запирательную клетку и внутреннюю подвздошную кость (не маркируется)  Лимфодренаж мочевого пузыря (вид сбоку). Опухоли надбоковой стенки мочевого пузыря распространяются на внешние подвздошные лимфатические узлы
Лимфодренаж мочевого пузыря (вид сбоку). Опухоли надбоковой стенки мочевого пузыря распространяются на внешние подвздошные лимфатические узлы Рак мочевого пузыря находится в стадии распространения рака) и градации (насколько ненормальные и агрессивные клетки выглядят под микроскопом) для определения лечения и оценки результатов. Определение обычно стадии за первой трансуретральной резекцией опухоли мочевого пузыря (ТУР мочевого пузыря). Папиллярные опухоли, ограниченные слизистой оболочкой или поражающие собственная пластинка пластинки, классифицируются как Ta или T1. Плоские поражения классифицируются как Тис. Оба сгруппированы вместе как неинвазивные заболевания мышц для терапевтических целей.
В системе стадирования TNM (8-е изд. 2017 г.) рака мочевого пузыря:
T (первичная опухоль)
N (лимфатические узлы)
M (отдаленные метастазы)
Наиболее частые места для метастазов рака мочевого пузыря лимфатические узлы, кости, легкие, печень и брюшина. Наиболее частыми сторожевыми лимфатическими узлами дренирующим раком мочевого пузыря являются запирательные и внутренние подвздошные лимфатические узлы. Расположение лимфатического распространения зависит от расположения опухолей. Опухоли на надбоковой стенке мочевого пузыря распространяются на внешние подвздошные лимфатические узлы. Опухоли шеи, передней стенки и глазного дна обычно распространяются на внутренние подвздошные лимфатические узлы. Из региональных лимфатических узлов (т.е. запирательных, внутренних и внешних лимфатических узлов) рак распространяется на отдаленные участки, такие как общие подвздошные лимфатические узлы и парааортальные лимфатические узлы. Пропущенные лимфатические узлы обнаружения не наблюдаются при раке мочевого пузыря.
Числовые . Вышеуказанные стадии интегрировать в числовую стадию (с римскими цифрами ) следующим образом:
| Стадия | Опухоль | Узлы | Метастаз | 5-летняя выживаемость в США |
|---|---|---|---|---|
| Стадия 0a | Ta | N0 | M0 | 98% |
| Этап 0is | Tis | N0 | M0 | 95% |
| Этап I | T1 | N0 | M0 | 63% |
| Этап II | T2a | N0 | M0 | |
| T2b | ||||
| Этап IIIA | T3a | N0 | M0 | 35% |
| T3b | ||||
| T4a | ||||
| T1-4a | N1 | |||
| Стадия IIIB | T1-4a | N2 | M0 | |
| N3 | ||||
| Стадия IVA | T4b | Любая N | M0 | |
| Любая T | M1a | |||
| Стадия IVB | Любой T | ny N | M1b | 5% |
Согласно классификации ВОЗ (1973) рак мочевого пузыря гистологически классифицируется на:
классификация (2004/2016)
Люди с немышечно-инвазивным раком мочевогоря (NMIBC) стратифицируются по риску на основе клинических и патологических факторов, чтобы их лечили надлежащим образом в зависимости от вероятности прогрессирования и / или повторения. Люди с неинвазивными мышечными опухолями делятся на группы с низким, средним и высоким риском или имеют числовую оценку риска. Структура риска обеспечивается Американской стратификацией урологов / Обществом урологической онкологии (стратификация AUA / SUO), руководящими принципами Европейской ассоциации урологов (EAU), таблицами риска Европейской организации по исследованию и лечению рака (EORTC) и Club Urológico Español de Tratamiento. Модель оценки Oncológico (CUETO).
| Низкий риск | Средний риск | Высокий риск |
|---|---|---|
| Солитарная Ta-опухоль низкой степени злокачественности, менее 3 см | Рецидив в течение 1 года, опухоль Ta низкой степени | T1 высокой степени |
| Папиллярное уротелиальное новообразование с низким потенциалом злокачественности | Одиночная опухоль Ta низкой степени, больше 3 см | Любая рецидивирующая опухоль или любой высокой степени |
| Низкая степень злокачественности, мультифокальные опухоли | Высокая степень злокачественности, больше 3 см (или мультифокальные) | |
| Высокая степень Ta, менее 3 см | Любая карцинома in situ | |
| Низкая степень T1 | Любая неудача БЦЖ в опухолях высокой степени | |
| Любой вариант гистологии | ||
| Любая лимфоваскулярная инвазия | ||
| Любая высокая степень поражения простаты и уретры |
В моделях EORTC и CUETO используется совокупный балл, полученный на основе и индивидуальных прогностических факторов, которые преобразуют прогрессирующий риск и рецидив. Шесть прогностических факторов, включенных в модель EORTC, - это количество опухолей, частота рецидивов, Т-стадия, наличие карциномы in-situ и степень опухоли. Оценка повторения в модели CUETO включает 6 чисел; возраст, пол, степень, статус опухоли, количество опухолей и наличие тис. Для оценки прогресса используются предыдущие 6 чисел плюс стадия T.
| Модель | Совокупная оценка рецидива | Повторение при 1 -год (%) | Рецидив через 5 лет (%) |
|---|---|---|---|
| EORTC | 0 | 15 | 31 |
| 1-4 | 24 | 46 | |
| 5-9 | 38 | 62 | |
| 10-17 | 61 | 78 | |
| CUETO | 0-4 | 8.2 | 21 |
| 5-6 | 12 | 36 | |
| 7-9 | 25 | 48 | |
| 10 -16 | 42 | 68 |
| Модель | Совокупный балл прогрессирования | Прогресс через 1 год (%) | Прогресс за 5 лет (%) |
|---|---|---|---|
| EORTC | 0 | 0,2 | 0,8 |
| 2-6 | 1 | 6 | |
| 7-13 | 5 | 17 | |
| 12-23 | 17 | 45 | |
| CUETO | 0-4 | 1.2 | 3,7 |
| 5-6 | 3 | 12 | |
| 7-9 | 5,5 | 21 | |
| 10-16 | 14 | 34 |
По состоянию на 2019 год имеется ограниченное количество свидетельств высокого уровня, позволяющих предположить, что потребление овощей и овощей фруктов уменьшаетс я рака риска мочевого пузыря. Исследование 2008 года пришло к выводу, что «верх фрукты и овощи могут снижать риск рака мочевого пузыря». Фрукты и желто-оранжевые овощи, особенно морковь и овощи, содержащие селен, вероятно, связаны с умеренно сниженным риском рака мочевого пузыря. Цитрусовые фрукты и овощи семейства крестоцветных также были известны как обладающие возможно защитным действием. Однако анализ 47 909 мужчин в соответствии с показателем среди тех мужчин, которые потребляли большое количество овощи семейства крестоцветных. Обратное соотношение между поступлением флавонолов и лигнанов (дифенольных соединений, обнаруженных в цельнозерновых, бобовых, фрукты и овощи) и агрессивный рак мочевого пузыря.
Закон, что полифенольные соединения в чае могут иметь подавляющее действие на образование и рост опухоли мочевого пузыря, есть ограниченные доказательства того, что употребление чая снижает риск рака мочевого пузыря.
В 10-летнем исследовании с участием почти 49000 мужчин исследователи открылись, что мужчины, которые выпили не менее 1,44 л. воды (около 6 чашек) в день снижает риск рака мочевого пузыря по сравнению с мужчинами, которые меньше пьют. Было также обнаружено, что: «риск рака мочевого пузыря снижается на 7% на каждые 240 мл добавленной жидкости». Авторы предположили, что рак мочевого пузыря может частично быть вызван прямым контактом мочевого пузыря с канцерогенами, которые выделяются с мочой, хотя это еще не подтверждено другими исследованиями.
По состоянию на 2019 г. недостаточно данных, чтобы определить, является ли скрининг на рак мочевого пузыря у людей без медицинского лечения или нет.
 Схема лечения
Схема лечения Лечение рака мочевого пузыря зависит от того, насколько опухоль проникает в стенку мочевого пузыря.
Стратегии лечения рака мочевого пузыря, включая:
Немышечно-инвазивный рак мочевого пузыря (те, не проникают в мышечный слой мочевого пузыря), можно «сбрить» с помощью электрокоагуляции, присоединенное к цистоскопу, которое в этом случае называется резектоскопом. Процедура называется трансуретральной резекцией опухоли мочевого пузыря (ТУР мочевого пузыря) и служит в первую очередь для определения стадии патологии. В случае немышечно-инвазивного рака мочевого пузыря ТУР мочевого пузыря сама по себе является лечением, но в случае мышечно-инвазивного рака этой процедуры недостаточно для окончательного лечения. Кроме того, при первичной ТУР порекомендована цистоскопия в синем свете с использованием агента оптической визуализации гексаминолевулината (HAL), чтобы улучшить обнаружение поражения (особенно карциномы in situ) и улучшить качество резекции, тем самым уменьшив рецидив. Важно оценить качество резекции, если есть доказательства неполной резекции или в образце нет мышцы (без которой невозможно определить инвазивность мышц), настоятельно рекомендуется повторная ТУР. Более того, почти у половины людей с неинвазивным заболеванием высокой степени злокачественности остается остаточная опухоль после первичной ТУРМГ, в таких случаях повторная ТУРМТ важна для предотвращения занижения стадии. На этом этапе рекомендуется классифицировать людей по группам риска. Лечение и наблюдение для различных групп риска указаны в таблице ниже.
 Медикаментозное лечение (химиотерапия) в мочевой пузырь (внутрипузырное)
Медикаментозное лечение (химиотерапия) в мочевой пузырь (внутрипузырное) Однократная инстилляция химиотерапии в мочевой пузырь после первичной ТУРМТ показала преимущество в снижении частоты рецидивов на 35% при неинвазивных заболеваниях. Для этой цели можно использовать следующие препараты: митомицин C (MMC), эпирубицин, пирарубицин и гемцитабин. Инстилляцию послеоперационной химиотерапии следует проводить в течение первых нескольких часов после ТУР. Известно, что со временем остаточные опухолевые клетки прочно прилипают и покрываются эффективностью внеклеточным матриксом, что снижает инстилляции. Наиболее частый побочный эффект - химический цистит и раздражение кожи. Если есть подозрение на перфорацию мочевого пузыря во время ТУР, химиотерапию не следует вводить в мочевой пузырь, поскольку известно, что серьезные побочные эффекты возникают из-за экстравазации лекарственного средства. Исследования показали, что эффективность химиотерапии повышается при использовании химиотерапии с помощью устройства. Эти технологии используют механизмы для облегчения абсорбции и действия химиотерапевтического препарата, вводимого в мочевой пузырь. Другая технология - электродвижущее введение лекарств (EMDA) - использует электрический ток для увеличения абсорбции лекарства после хирургического удаления опухоли. Другая технология, термотерапия, использует радиочастотную энергию для прямой стенки мочевого пузыря, что вместе с химиотерапией (химиогипертермией) показывает синергетический эффект, повышая способность друг друга уничтожать опухолевые клетки.
 Ослабленный шрам M. bovis, использованный для лечения рака мочевого пузыря
Ослабленный шрам M. bovis, использованный для лечения рака мочевого пузыря Иммунотерапия с помощью Bacillus Calmette - Guérin (BCG ), также доставляется в мочевой пузырь. используется для лечения и предотвращения рецидивов NMIBC. БЦЖ - это вакцина против туберкулеза, приготовленная из ослабленной (ослабленной) живой туберкулезной палочки крупного рогатого скота, Mycobacterium bovis, которая потеряла свою вирулентность для человека. БЦЖ иммунотерапия эффективна до 2/3 случаев на этой стадии, и в рандомизированных исследованиях было показано, что она превосходит стандартную химиотерапию. Точный механизм, с помощью которого БЦЖ предотвращает рецидив, неизвестен. Однако показано, что бактерии поглощаются раковыми клетками. Инфекция этих клеток в мочевом пузыре может вызвать локализованную иммунную реакцию, которая очищает остаточные раковые клетки.
БЦЖ доставляется как индукционный, так и поддерживающий курс. Индукционный курс состоит из 6-недельного курса внутрипузырной и чрескожной БЦЖ. Затем следует курс обслуживания. Нет единого относительно графика технического обслуживания, однако наиболее распространенным является график Юго-западной онкологической группы (SWOG). График поддерживающей терапии SWOG состоит из внутрипузырного и чрескожного БЦЖ каждую неделю в течение 3 недель, вводимых через 3, 6, 12, 18, 24, 30 и 36 месяцев. Трехнедельный поддерживающий режим с индукцией показал частоту полного ответа 84% по сравнению с 69% у людей, которые обеспечивают 6-недельную индукцию БЦЖ только через 6 месяцев. Во многих исследованиях изучались альтернативные схемы лечения и режимы БЦЖ, но они не показали клинического значения. Эффективность различных штаммов БЦЖ (Connaught, TICE, Pasteur, Tokio-172) не различается, однако доказательств высокого уровня нет.
Побочные эффекты БЦЖ-го Лечение включает цистит, простатит, эпидидимоорхит, баланит, обструкцию мочеточника, сокращение мочевого пузыря, микобактериальные инфекции остеомиелит, реактивный артрит, микобактериальная пневмония, , гранулематозный гепатит, гранулематозный нефрит, интерстициальный нефрит, инфекционный васкулит и диссеминированный
Местная инфекция (например, простатит, эпидидимоорхит, баланит ), вызванная БЦЖ, должна, лечить тройной туберкулезной терапией с одним из препаратов - фторхинолон на срок от 3 до 6 месяцев. Людям с системными инфекциями следует прекратить терапию БЦЖ и начать противотуберкулезное лечение множественными препаратами в течение не менее 6 месяцев. Для этого лечения можно использовать следующие препараты: INH, рифампицин, этотмбутол, фторхинолоны, кларитромицин, аминогликозиды и доксициклин. Штаммы БЦЖ нечувствительны к пиразинамиду, поэтому они не должны быть частью противотуберкулезного лечения.
Неэффективность лечения БЦЖ может быть классифицирована на 3 группы; Рецидив БЦЖ, резистентность к БЦЖ и непереносимость БЦЖ. При рецидиве БЦЖ опухоль рецидивирует после периода без болезни. БЦЖ-резистентные опухоли - это опухоли, которые не реагируют на индукционные и поддерживающие дозы, БЦЖ или которые прогрессируют во время терапии. При непереносимости БЦЖ опухоль рецидивирует из-за неполного лечения, поскольку человек, получающий ее, не может переносить индукционный курс БЦЖ. Около 50% людей не проходят лечение БЦЖ и нуждаются в дальнейшем лечении.
Людей, у которых опухоли рецидивировали после лечения, лечить труднее. Для таких людей рекомендуется радикальная цистэктомия. Людям, у которых нет ответа на терапию БЦЖ, которые не подходят или не желают проходить радикальную цистэктомию, можно рассмотреть возможность лечения спасением. Спасательная терапия включает внутрипузырную химиотерапию такими агентами, как валрубицин, гемцитабин или доцетаксел, химиолучевую терапию или химиогипертермию.
| Риск | Другие соображения | Химиотерапия | Иммунотерапия (БЦЖ) | Цистоскопия (наблюдение) | Визуализация (наблюдение) |
|---|---|---|---|---|---|
| Низкое | через 3 месяца с цистоскопией через 12, ежегодно в течение 5 лет | КТ / М урография и КТ / МРТ брюшной полости и таза на исходном уровне | |||
| Средний | Первичный опухоль с химиотерапией в анамнезе | Внутрипузырная химиотерапия в течение 1 года ИЛИ Внутрипузырная БЦЖ в течение 1 года (предпочтительно) | через 3 месяца с цитологическим исследованием с последующим проведением один раз каждые 3–6 месяцев в течение 5 лет и ежегодно | КТ / МРТ урография и КТ / МРТ брюшной полости и таза на исходном уровне | |
| Рецидивирующие опухоли с предшествующей химиотерапией в анамнезе | Внутрипузырная БЦЖ в течение 1 года | ||||
| Высокая | Внутрипузырная БЦЖ для 3 года (при переносимости) | че рез 3 месяца с цитологическим исследованием, затем один раз в 3 месяца в течение 2 лет, после этого, 6 месяцев в течение 5 лет, ежегодно | КТ / МР-урография и КТ / МРТ брюшной полости и таза в исходный уровень, КТ / МР-урография 1-2 раза в год в течение 10 лет | ||
| T1G3 / Высокая степень, лимфоваскулярная инвазия, наличие вариантов гистологии | Рассмотреть возможность радикальной цистэктомии | ||||
 Хирургическая реконструкция (новый пузырь)
Хирургическая реконструкция (новый пузырь) Нелеченные, немышечно-инвазивные опухоли могут постепенно начать проникать в мышечную стенку мочевого пузыря (мышечно-мочевого пузыря). Опухоли, которые инфильтрируют стенку мочевого пузыря, требуют более радикального хирургического вмешательства, при котором часть (частичная цистэктомия ) или вся (радикальная цистэктомия ) мочевого пузыря удаляется (цистэктомия), а поток мочи отводится в изолированную петлю кишечника (так называемый подвздошный канал или уростомия ). В некоторых случаях опытные хирурги могут создать заменяющий мочевой пузырь (новый пузырь ) из сегмента кишечной ткани, но это во многом зависит от предпочтений человека, возраста человека, функции почек, и место болезни. Двусторонняя тазовая лимфаденэктомия должна сопровождаться радикальной цистэктомией. Как минимум, после стандартного шаблона лимфаденэктомии следует удалить внешний и внутренний подвздошный и запирательный лимфатический узел. Радикальная цистэктомия сопряжена с серьезными осложнениями. Около 50-65% людей испытывают осложнения в течение 90 дней после операции. Летальность составила 7% в течение 90 дней после операции. Центры с большим объемом имеют лучшие результаты, чем центры с низким объемом. Некоторые центры внедряют рекомендации общества «Улучшенное восстановление после операции» (ERAS) по снижению заболеваемости после радикальной цистэктомии. Однако из-за конкретных доказательств в урологической хирургии протокол ERAS не получил широкого распространения в урологической клинической помощи.
Даже после хирургического удаления мочевого пузыря 50% людей с мышечно-инвазивным заболеванием (T2-T4)) в течение двух лет развиваются метастазы из-за микрометастазов. В таких случаях неоадъювантная химиотерапия (химиотерапия перед основным лечением, т.е. хирургическим вмешательством) увеличение общей выживаемости через 5 лет с 45% до 50% с абсолютным преимуществом выживаемости на 5%. В настоящее время два наиболее используемых режима химиотерапии для неоадъювантной химиотерапии на платине; метотрексат, винбластин, доксорубицин, цисплатин (MVAC) и гемцитабин с цисплатином (GC). Другие схемы включают плотные дозы MVAC (DDMVC) и цисплатин, метотрексат и винбластин (CMV). Хотя используется режим не установлен, предпочтительным режимом неоадъювантной терапии является MVAC.
Роль адъювантной химиотерапии (химиотерапия после основного лечения) ограничена с опухолями высокой степени злокачественности (pT3 / T4 и / или N +) и которые не имеют неоадъювантную терапию. Адъювантная лучевая терапия не показала каких-либо преимуществ при лечении рака мочевого пузыря.
| MVAC | DDMVAC | Гемцитабин + цисплатин |
|---|---|---|
| Метотрексат (30 мг / мв внутривенно) - 1,15,22 Винбластин (3 мг / м внутривенно) - дни 2, 15, 22 Доксорубицин (30 мг / м внутривенно) - день 2 Цисплатин (70 мг / м в / в) - день 2 Повторять каждые 4 недели в течение 3 циклов | Метотрексат (30 мг / м в / в) - день 1 Винбластин (3 мг / м внутривенно) - 2 день Доксорубицин (30 мг / м внутривенно) - день 2 Цисплатин (70 мг / м внутривенно) - день 2 Гранулоцитарный колониестимулирующий фактор (G-CSF) (240 мкг / м подкожно) - день 4-10 Повторять каждые 2 недели в течение 3–4 циклов | Гемцитабин (1000 мг / м внутривенно) - день 1,8,15 Цисплатин (70 мг / м) - день 2 Повторять каждые 4 недели в течение 4 циклов |
Комбинация облучения и химиотерапии (химиолучевой терапии) в сочетании У некоторых людей в качестве альтернативы может быть трансуретральная (эндоскопическая) резекция опухоли мочевого пузыря. Обзор доступных больших серий данных по этой так называемой тримодальной терапии, перенесших радикальную цистэктомию с реконструкцией мочи, показал аналогичные показатели долгосрочной специфической выживаемости при помощи улучшенного общего качества жизни, как и у людей. Однако в настоящее время отсутствуют рандомизированные контрольные исследования, которые сравнивалась бы тримодальная терапия с радикальной цистэктомией. Люди, которые проходят тримодальную терапию, обычно отбираются и обычно имеют заболевание Т2 без гидронефроза и / или карциномы in-situ. Пятилетняя специфическая выживаемость после тримодальной терапии составляет от 50% до 82% и от 36% до 74%.
При тримодальной терапии проводят максимальную ТУРПТ с предыдущей химиолучевой терапией. Используются схемы химиотерапии, повышающие чувствительность к облучению, состоящие из цисплатина или 5-флуроурацила и митомицина С. Лучевая терапия - это внешняя лучевая терапия (ДЛТ ) с целью лечебной дозой 64-66 Гр. Наблюдение за прогрессированием или рецидивомомиться с помощью компьютерной томографии, цистоскопии и цитологического исследования мочи. Побочные эффекты химиолучевой терапии включают тошноту, рвоту, потерю аппетита, выпадение волос, язвы во рту, диарея, запор, повышенный риск инфекций и кровотечение и утомляемость.
Людям, не получившим эффект от тримодальной терапии, рекомендуется радикальная цистэктомия, если есть мышечные инвазивные или рецидивирующие опухоли. Примерно 25-30% пациентов не проходят лечение радикальной цистэктомии. ТУРМГ с внутрипузырной терапией после неудачного лечения немышечно-инвазивного заболевания.
У людей с единственной опухолью без сопутствующей карциномы in situ в области, где могут быть чистые хирургические поля. достигнута, можно рассмотреть возможность частичной цистэктомии с лимфаденэктомией. План лечения, включающий частичную цистэктомию, должен сопровождаться неоадъювантной химиотерапией. У людей с урахальной аденокарциномой мочевого пузыря может быть рассмотрена частичная цистэктомия с блочной резекцией урахальной связки и пупка.
Комбинированная химиотерапия, содержащая цисплатин, является стандартом лечения метастатического мочевого пузыря. Пригодность к химиотерапии на основе цисплатина оценивается до начала лечения. Человек считается непригодным, если верно одно из следующих утверждений.
Люди, признанные подходящими, получают схемы на основе платины; метотрексат, винбластин, доксорубицин с цисплатином (MVAC) или гемцитабин с цисплатином (GC). Альтернативные схемы включают паклитаксел с гемцитабином и цисплатином (PCG, тройная терапия) и цисплатином, метотрексатом и винбластином (CMV). Частота ответа на комбинацию на основе цисплатина колеблется от 39 до 65%, полный ответ наблюдается у 12-35 человек. MVAC лучше переносится, если он сочетается с гранулоцитарным колониестимулирующим фактором и режим известен как режим плотной дозы MVAC (DDMVAC). Эта комбинация снижает смертность от всех причин. Режим MVAC агрессивен. Фебрильная нейтропения (лихорадка из-за уменьшения лейкоцитов) возникает у 10-14%, а смерть из-за токсичности - примерно у 3-4%. Общие побочные эффекты MVAC включают подавление костного мозга, лихорадку из-за снижения лейкоцитов, сепсис, мукозит и тошноту и рвота.. В отличие от этого, схема ГК показала более низкую частоту нейтропенического сепсиса и 3/4 мукозита степени по сравнению с MVAC. Были предприняты попытки повышения переносимости схемы лечения на основе цисплатина путем его химиотерапии на основе карбоплатина. Однако терапия на основе цисплатина превосходит химиотерапию на основе карбоплатина в достижении общего и полного ответа. Тем не менее, почти половина людей с метастазами «непригодны» для терапии на основе цисплатина. У таких людей комбинация карбоплатина и гемцитабина (GemCarbo) может быть в качестве первой линии химиотерапии. Людям, которые не подходят для какой-либо химиотерапии на основе платины и экспрессию PD-L1, можно использовать атезолизумаб и пембролизумаб.
Люди с метастазами в кости должны получать бисфосфонаты или деносумаб для предотвращения событий, связанных со скелетом (например, переломы, компрессия спинного мозга, боль в костях).
| DDMVAC | Гемцитабин + цисплатин |
|---|---|
| Метотрексат (30 мг / м в / в) - день 1 Винбластин (3 мг / м внутривенно) - день 2 Доксорубицин (30 мг / м внутривенно) - день 2 Цисплатин (70 мг / м внутривенно) - день 2 Гранулоцитарный колониестимулирующий фактор (G-CSF) (240 мкг / м подкожно) - день 4-10 Повторять каждые 2 недели в течение 3–4 циклов | Гемцитабин (1000 мг в / м в / в) - день 1,8,15 Цисплатин (70 мг / м) - день 2 Повторять каждые 4 недели в течение 4 циклов |
| Атезолизумаб (при PD-L1 +) | Гемцитабин + карбоплатин | Пролембизумаб (при PD-L1 +) |
|---|---|---|
| Атезолизумаб (атезолизумаб, 1200 мг внутривенно) каждые 3 недели | Гемцитабин (1000 мг / м внутривенно) - день 1,8 Карбоплатин (4,5 × [скорость клубочковой фильтрации + 25]) - день 1 и каждые 3 недели | Пембролизумаб 200 мг каждые 3 недели |
Рефрактерный рак мочевого пузыря или прогрессирование после химиотерапии на основе платины можно лечить с помощью химиотерапии второй линии или иммунотерапии.
Наиболее часто используемая химиотерапия второй линии - это режимы монотерапии таксанов (паклитаксел, наб-паклитаксел и доцетаксел ). Другие однокомпонентные схемы включают винфлунин, алкалоид барвинка третьего поколения (одобрен в Европе), гемцитабин, пеметрексед, Оксалиплатин и ифосфамид. Побочные эффекты винфлунина включают нейтропению, запор, утомляемость и анемию, и его использование в качестве средств второй линии ограничено. Ответ на химиотерапию второй линии наблюдается у 5–20% людей. Средняя выживаемость без прогрессирования заболеваний при химиотерапии второй линии составляет 3–4 месяца.
У людей с мутациями рецепторов факторов роста фибробластов (FGFR ) и неэффективностью стандартной химиотерапии на основе платины эрдафитиниб можно использовать. Эрдафитиниб показал эффективность 40% у этих пациентов. В США разрешено использовать пять иммунотерапевтических агентов для лечения метастатического рака мочевого пузыря. Они путем ингибирования белка 1 запрограммированной гибели клеток (PD-1) или лиганда 1 запрограммированной гибели клеток (PD-L1). пембролизумаб и ниволумаб и ингибиторами лиганда 1 запрограммированной гибели клеток (PD-1). Авелумаб, атезолизумаб и дурвалумаб ингибиторами PD-L1.
| Атезолизумаб | Ниволумаб | Пембролизумаб | Дурвалумаб | Авелумаб |
|---|---|---|---|---|
| Атезолизумаб 1200 мг внутривенно каждые 3 недели | Ниволумаб 3 мг / кг внутривенно каждые 2 недели | Пембролизумаб 200 мг каждые 3 недели | Дурвалумаб 10 мг / кг каждые 2 недели в течение 12 месяцев | Авелумаб 10 мг / кг внутривенно каждые 2 недели |
Контрастное усиление CT используется для мониторинга легких, печени, и метастазы в лимфатические узлы. сканирование кости используется для обнаружения и мониторинга метастазов в кости. Ответ на лечение измеряют с использованием критериев оценки ответа в солидных опухолях (RECIST ) в одной из следующих групп; ответ (полный или частичный), стабильное заболевание и прогрессирующее заболевание.
Люди с немышечно-инвазивными опухолями имеют благоприятный исход (5-летняя выживаемость 95% против 69%). мышечно-инвазивного рака мочевого пузыря). Однако у 70% из них будет рецидив после начального лечения, а у 30% из них будет инвазивное заболевание мышц. Рецидив и прогрессирование до более высокой стадии заболевания имеют менее благоприятный исход.
Выживаемость после радикальной цистэктомии и диссекции тазовых лимфатических узлов зависит от патологической стадии. Если заболевание не распространилось на лимфатический узел и ограничивается мочевым пузырем (T1 или T2, N0), 5-летняя выживаемость составляет 78%. Если он распространился локально по области мочевого пузыря без вовлечения лимфатического узла (T3, N0), то 5-летняя выживаемость падает до 47%. При заболевании с распространением лимфатических узлов (N +, независимо от стадии T) 5-летняя выживаемость составляет 31%. Местнораспространенное и метастатическое заболевание резко снижает выживаемость, при этом средняя выживаемость без химиотерапии составляет 3–6 месяцев. Химиотерапия на основе цисплатина увеличила среднюю выживаемость до 15 месяцев. Однако 5-летняя выживаемость все еще составляет 15%.
Существует несколько прогностических факторов, которые определяют выживаемость при раке после радикальной цистэктомии. Факторами, отрицательно влияющими на выживаемость при раке, являются пожилой возраст, более высокая степень опухоли и патологическая стадия, лимфатический узел метастаз, наличие лимфоваскулярной инвазии и положительный край мягких тканей. Плотность лимфатических узлов (положительные лимфатические узлы / всего лимфатических узлов, наблюдаемые в образце после операции) является прогностическим фактором выживаемости при поражении лимфатических узлов. Чем выше плотность, тем ниже выживаемость.
После радикальной цистэктомии мочеиспускательная и сексуальная функция остаются хуже, чем у населения в целом. У людей с неоплазматическим пузырем лучше эмоциональная функция и образ тела по сравнению с людьми с кожным отводом (которым необходимо носить мешок для сбора мочи через живот). Социальные факторы, такие как семья, отношения, здоровье и финансы, в значительной степени определяют хорошее качество жизни людей, у которых был диагностирован рак мочевого пузыря.
Большой процент людей с раком мочевого пузыря тревожно и депрессия. Молодые, одинокие люди с запущенным клиническим заболеванием имеют высокий риск получить диагноз психического заболевания после лечения. Люди, страдающие психическим заболеванием после лечения, по-видимому, имеют худшую специфическую для рака и общую выживаемость.
| Рейтинг | Страна | В целом | Мужчины | Женщины |
|---|---|---|---|---|
| 1 | Ливан | 25 | 40 | 9 |
| 2 | Греция | 21 | 40 | 4 |
| 3 | Дания | 18 | 29 | 8 |
| 4 | Венгрия | 17 | 27 | 9 |
| 5 | Албания | 16 | 27 | 6 |
| 5 | Нидерланды | 16 | 26 | 8 |
| 7 | Бельгия | 16 | 27 | 6 |
| 8 | Италия | 15 | 27 | 6 |
| 9 | Германия | 15 | 26 | 6 |
| 10 | Испания | 15 | 27 | 6 |
 Стандартизованная по возрасту смерть от рака мочевого пузыря на 100 000 жителей в 2004 году.
Стандартизованная по возрасту смерть от рака мочевого пузыря на 100 000 жителей в 2004 году. Во всем мире в 2017 году рак мочевого пузыря стал причиной 196 000 смертей, что составляет 5,4%. (с поправкой на возраст ) по сравнению с 2007 годом. В 2018 году скорректированный по возрасту уровень новых случаев рака мочевого пузыря составил 6 случаев на 100 000 человек, а скорректированный по возрасту коэффициент смертности составил 2 смерти на 100 000 человек.. Ливан и Греция имеют самый высокий уровень новых случаев. В Ливане этот высокий риск связан с большим количеством курильщиков и нефтехимическим загрязнением воздуха.
Риск возникновения рака мочевого пузыря у мужчин в четыре раза выше, чем в женщины. Курение может лишь частично объяснить более высокие показатели среди мужчин в западном полушарии. Еще одна причина заключается в том, что рецептор андрогена, который гораздо более активен у мужчин, чем у женщин, может играть роль в развитии рака. Эта гипотеза также подтверждается тем фактом, что мужчины, проходящие супрессивную терапию андрогенами по несвязанной причине, по-видимому, имеют более низкий риск развития рака мочевого пузыря. В Африке мужчины более склонны к полевым работам и подвержены заражению шистосомой, это может в определенной степени объяснять разницу в заболеваемости плоскоклеточным раком в областях, где находится мочевой пузырь. рак является эндемическим. Однако у женщин более агрессивное заболевание и худшие результаты, чем у мужчин. Эта разница в результатах объясняется многочисленными факторами, такими как различие в воздействии канцерогенов, генетика, социальное положение и качество медицинской помощи. Одним из распространенных признаков рака мочевого пузыря является гематурия, который довольно часто ошибочно диагностируется как инфекция мочевыводящих путей у женщин, что приводит к задержке постановки диагноза. Более того, как упоминалось ранее, ген PSCA может играть роль в агрессивных опухолях у женщин.
Рак мочевого пузыря является шестым по распространенности раком, на который приходится 3,7% новых случаев рака. в 2018 году 30700 канадцев жили с раком мочевого пузыря, было диагностировано 9160 новых случаев, 2467 умерли от него. По оценкам, в 2019 году будет диагностировано 11800 новых случаев заболевания, и 2500 человек умрут от этого. Из 11 800 новых случаев 9100 будут у мужчин и 2700 - у женщин. Из 2500 человек, которые умрут от него, 1800 будут мужчинами и 700 - женщинами.
Рак мочевого пузыря занимает 14-е место по распространенности и 16-е место средипричин смерти от рака. В 2018 году на его долю пришлось 82,3 тысячи новых случаев заболевания и 38,2 тысячи смертей. Количество новых случаев сравнительно ниже по сравнению с западными аналогами. У большинства людей диагностировано немышечно-инвазивное заболевание (75%), а у остальных - мышечно-инвазивное заболевание (25%). Карцинома in situ присутствовала только в 2,4% случаев.
В 2015 году в Европейском союзе было диагностировано 131 000 новостных случаев, из которых 40 000 умерли. Это 5-й по частоте рак и 9-й по частоте причиной смерти от рака. Относительная 5-летняя выживаемость для рака мочевого пузыря, диагностированного между 2000 и 2007 годами, составляет 69%. Географические различия наблюдаются в показателях выживаемости: 5-летняя выживаемость составляет от 75% в Северной Европе до 65% в Восточной Европе.
Рак мочевого пузыря является девятым по распространенности раком среди <341 На Великобританию приходится 2,7% всех новых случаев рака. В 2018 году было зарегистрировано 12 200 новых случаев заболевания, и 6100 человек умерли от него.
В США в 2019 году ожидается 80 470 случаев и 17 670 смертей, что делает это шестой по распространенности тип рака в регионе. Рак мочевого пузыря - четвертый по распространенности тип рака у мужчин и двенадцатый по частоте у женщин. Около 62 000 мужчин и 19 000 женщин диагностирован рак мочевого пузыря в 2019 году. В период с 2012 по 2016 год ежегодный уровень новых случаев рака мочевого пузыря снижался на один процент в год.
| Классификация | D |
|---|---|
| Внешние ресурсы |