| инозитол-1 (или 4) -монофосфатаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
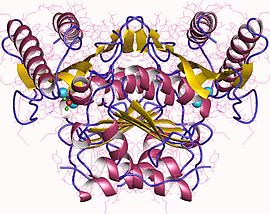 Инозитолмонофосфатаза 2, димер, человек Инозитолмонофосфатаза 2, димер, человек | |||||||||
| Идентификаторы | |||||||||
| Номер EC | 3.1.3.25 | ||||||||
| Номер CAS | 37184-63-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| KEGG | Запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
| Инозитолмонофосфатаза 1 | |
|---|---|
| Идентификаторы | |
| Символ | IMPA1 |
| Альт. символы | IMP; IMPA |
| ген NCBI | 3612 |
| HGNC | 6050 |
| OMIM | 602064 |
| RefSeq | NP_001138350 |
| UniProt | P29218 |
| Прочие данные | |
| Номер ЕС | 3.1.3.25 |
| Locus | Chr. 8 q21.1-q21.3 |
| Инозитолмонофосфатаза 2 | |
|---|---|
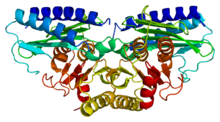 Рентгеновская кристаллическая структура инозитолмонофосфатазы 2 Рентгеновская кристаллическая структура инозитолмонофосфатазы 2 | |
| Идентификаторы | |
| Символ | IMPA2 |
| NCBI-ген | 3613 |
| HGNC | 6051 |
| OMIM | 605922 |
| RefSeq | NP_055029 |
| UniProt | O14732 |
| Другие данные | |
| Номер EC | 3.1. 3.25 |
| Locus | Chr. 18 p11.2 |
| Инозитолмонофосфатаза 3 | |
|---|---|
| Идентификаторы | |
| Символ | IMPAD1 |
| Альт. символы | IMPA3 |
| ген NCBI | 54928 |
| HGNC | 26019 |
| OMIM | 614010 |
| RefSeq | NP_060283 |
| UniProt | Q9NX62 |
| Прочие данные | |
| Номер ЕС | 3.1.3.25 |
| Locus | Chr. 8 q12.1 |
Инозитолфосфат-фосфатаза, обычно называемая IMPase, представляет собой ферменты из семейства ферментов фосфодиэстераз. Они участвуют в сигнальном пути фосфатидилинозитола [PI], который влияет на широкий спектр клеточных функций, включая, помимо прочего, рост клеток, апоптоз, секрецию и обработку информации. Ингибирование инозитолмонофосфатазы может быть ключевым в действии лития при лечении биполярного расстройства, в частности маниакальной депрессии.
Катализированная реакция:
 мио-инозит + фосфат
мио-инозит + фосфатЭтот фермент принадлежит к семейству гидролаз, особенно тех, которые действуют на фосфорные моноэфирные связи. систематическое название этого класса ферментов - мио-инозитолфосфатфосфогидролаза . Другие широко используемые названия включают:
Фермент представляет собой димер, содержащий 277 аминокислотных остатков на субъединицу. Каждый димер существует в 5-ти слоях чередующихся α-спиралей и β-листов, всего 9 α-спиралей и β-листов на субъединицу. IMPase имеет три гидрофильных полых активных центра, каждый из которых связывает молекулы воды и магния. Эти сайты связывания, по-видимому, консервативны в других фосфодиэстеразах, таких как фруктозо-1,6-бисфосфатаза (FBPase) и инозитолполифосфат-1-фосфатаза.
Это было Ранее сообщалось, что гидролиз инозитолмонофосфата катализируется ИМФазой через механизм 2-ионов магния. Однако недавняя кристаллическая структура с разрешением 1,4 A показывает, что 3 иона магния координируются в каждом активном связывающем сайте 2 димеров, поддерживая механизм 3-ионов магния. В настоящее время считается, что механизм гидролиза протекает как таковой: фермент активируется связыванием иона магния с участком связывания I, содержащим три молекулы воды, и стабилизируется отрицательными зарядами на карбоксилатах Glu70 и Asp90 и карбониле Ile92.. Другой ион магния затем кооперативно связывается с сайтом связывания 2, который состоит из карбоксилатов Asp90, Asp93, Asp220 и трех молекул воды, одна из которых разделяется сайтом связывания 1. Затем третий магний слабо и некооперативно с третьим сайт связывания, который имеет 5 молекул воды и остаток Glu70. После того, как все три иона магния связались, инозитолмонофосфатаза может связываться, а отрицательно заряженная фосфатная группа стабилизируется тремя положительно заряженными ионами магния. Наконец, активированная молекула воды действует как нуклеофил и гидролизует субстрат, давая инозитол и неорганический фосфат.
Инозитолмонофосфатаза играет важную роль в поддержании внутриклеточного уровня мио-инозита, молекулы, которая образует структурную основу нескольких вторичных мессенджеров в эукариотических клетках. IMPase дефосфорилирует изомеры инозитолмонофосфата с образованием инозита, в основном в форме стереоизомера, мио-инозита. Инозитолмонофосфатаза способна регулировать гомеостаз инозита, потому что она лежит в конвергенции двух путей, которые генерируют инозит :
В этом пути активируются рецепторы G-сопряженного белка и рецепторы тирозинкиназы, что приводит к активации фосфолипазы C (ПЛК). PLC гидролизует фосфатидилинозитолбифосфат (PIP 2), в результате чего образуется мембранно-связанный продукт диацилглицерин (DAG) и водорастворимый продукт инозитол. трифосфат (IP3). DAG действует как вторичный мессенджер, активируя несколько протеинкиназ и продуцируя расширенную передачу сигналов ниже по течению. IP3 также является вторым мессенджером, который активирует рецепторы эндоплазматического ретикулума для высвобождения запасов ионов кальция в цитоплазму, создавая сложную сигнальную систему, которая может участвовать в модуляции оплодотворения, пролиферации, сокращения, клеточного метаболизма, секреции везикул и жидкости и обработки информации. в нейрональных клетках. В целом, передача сигналов DAG и IP3 влияет на пластичность нейронов, влияя на долгосрочную потенциацию гиппокампа, индуцированные стрессом когнитивные нарушения и распространение конусов роста нейронов. Кроме того, PIP 2 не только является предшественником нескольких сигнальных молекул, но и может фосфорилироваться в 3'-положении, чтобы стать PIP3, который участвует в пролиферации, апоптозе и движении клеток.
На этом пути IMPase является обычным завершающим шагом в переработке IP3 для получения PIP 2. IMPase делает это путем дефосфорилирования инозитолмонофосфата с образованием неорганического фосфата и мио-инозитола, предшественника PIP2. Из-за решающей роли ИМФазы в этом сигнальном пути, она является потенциальной лекарственной мишенью для ингибирования и модуляции.
Существует как минимум 2 известных этапа в синтезе de novo мио-инозита из глюкозо-6-фосфата. На первом этапе глюкозо-6-фосфат превращается в D-инозитол-1-монофосфат под действием фермента глюкозо-6-фосфатциклазы. Инозитолмонофосфатаза катализирует последнюю стадию, на которой D-инозитол-1-монофосфат дефосфорилируется с образованием мио-инозита.
Инозитолмонофосфатаза исторически считалась прямой мишенью лития, первичное лечение биполярного расстройства. Считается, что литий действует согласно гипотезе истощения инозитола: литий оказывает терапевтический эффект, ингибируя IMPase и, следовательно, снижая уровни мио-инозитола. Научная поддержка этой гипотезы существует, но ограничена; Полная роль лития и инозитолмонофосфатазы в лечении биполярного расстройства или снижении уровней мио-инозитола изучена недостаточно.
В поддержку гипотезы истощения запасов инозита исследователи показали, что литий неконкурентоспособно связывается с очищенной бычьей ИМФазой в месте расположения одного из ионов магния. Грызуны, которым вводили литий, показали снижение уровня инозита в соответствии с гипотезой. Вальпроат, еще одно стабилизирующее настроение лекарство, которое назначают пациентам с биполярным расстройством, также имитирует эффекты лития на мио-инозит.
Однако некоторые клинические исследования показали, что у пациентов с биполярным расстройством, которым вводили литий, наблюдались более низкие уровни мио-инозитола, в то время как другие не обнаружили влияния на уровни мио-инозита. Кроме того, литий также связывается с инозитолполифосфат-1-фосфатазой (IPP), ферментом, также присутствующим в фосфоинозитидном пути, и может снижать уровни инозита посредством этого механизма. Требуются дополнительные исследования, чтобы полностью объяснить роль, которую литий и IMPase играют у пациентов с биполярным расстройством..
Несмотря на то, что литий эффективен при лечении биполярного расстройства, это чрезвычайно токсичный металл, и токсическая доза лишь незначительно превышает терапевтическую. Новый менее токсичный ингибитор IMPase может быть более желательным средством лечения биполярного расстройства. Такому ингибитору потребуется преодолеть гематоэнцефалический барьер, чтобы достичь IMPase в нейронах.