 | |
 | |
| Имена | |
|---|---|
| Название IUPAC Диэтилмалонат | |
| Предпочтительное название IUPAC Диэтилпропандиоат | |
| Другие названия Диэтилмалонат | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| Сокращения | DEM |
| Ссылка Beilstein | 774687 |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| ECHA InfoCard | 100.003.006 |
| Номер EC |
|
| MeSH | Диэтил + малонат |
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| Панель управления CompTox (EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
| Химическая формула | C7H12O4 |
| Молярная масса | 160,17 г / моль |
| Внешний вид | бесцветная жидкость |
| Плотность | 1,05 г / см, жидкость |
| Точка плавления | -50 ° C (-58 ° F; 223 K) |
| Точка кипения | 199 ° C (390 ° F; 472 K) |
| Растворимость в воде | незначительная |
| Кислотность (pK a) | 14 |
| Магнитная восприимчивость (χ) | -92,6 · 10 см / моль |
| Опасности | |
| Основные опасности | Вредно (X), легковоспламеняющееся (F) |
| Паспорт безопасности | Оксфорд Университетский паспорт безопасности материалов |
| Температура вспышки | 200 ° C (392 ° F; 473 K) |
| Родственные соединения | |
| Родственные соединения | Диметилмалонат. Малоновая кислота |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобокс | |
Диэтилмалонат, также известный как DEM, представляет собой диэтил сложный эфир малоновой кислоты. В природе встречается в виноград и клубника в виде бесцветной жидкости с яблочным -подобным запахом и используется в духи. Он также используется для синтеза других соединений, таких как барбитураты, искусственные ароматизаторы, витамин B 1 и витамин B 6.
Малоновая кислота представляет собой довольно простую дикарбоновую кислоту, с двумя карбоксильными группами, близкими друг к другу. При образовании диэтилмалоната из малоновой кислоты гидроксильная группа (-OH) на обеих карбоксильных группах заменяется этокси группой (-OEt; -OCH 2CH3). Метиленовая группа (-CH 2 -) в середине малоновой части молекулы диэтилмалоната соседствует с двумя карбонильными группами (-C (= O) -).
Атомы водорода на углероде, соседнем с карбонильной группой в молекуле, значительно более кислые, чем атомы водорода на углероде, соседнем с алкильными группами (до 30 порядков величины). (Это известно как α-положение по отношению к карбонилу.) Атомы водорода на атоме углерода, примыкающем к двум карбонильным группам, даже более кислые, потому что карбонильные группы помогают стабилизировать карбанион, возникающий в результате удаления протон из метиленовой группы между ними.
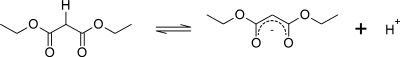
Степень резонансной стабилизации основания конъюгата этого соединения описывается тремя резонансными формами ниже:
Диэтилмалонат может быть получен взаимодействием натриевой соли хлоруксусной кислоты с цианидом натрия с последующим гидролизом основания полученного нитрила с получением натриевой соли малоновой кислоты. Этерификация Фишера дает диэтилмалонат:

Одним из основных применений этого соединения является синтез эфира малоновой кислоты. Карбанион (2 ), образованный реакцией диэтилмалоната (1 ) с подходящим основанием, может быть алкилирован подходящим электрофилом. Это алкилированное 1,3-дикарбонильное соединение (3 ) легко подвергается декарбоксилированию с потерей диоксида углерода с образованием замещенной уксусной кислоты (4 ):
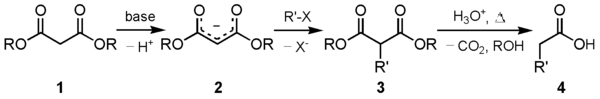
В общем, соли алкоксидного аниона, алкильная часть которого соответствует той, которая используется в указанном выше алкилировании, являются предпочтительными в качестве основания. Использование обычного основания может давать продукты гидролиза основания - например, гидроксид натрия будет просто давать малонат натрия и спирт, в то время как другие соли алкоксидов будут вызывать скремблирование в результате переэтерификации. Только «тот же» анион алкоксида, который использовался для алкилирования депротонированного активного метиленового сайта, предотвратит как гидролиз оснований, так и переэтерификацию.
Как и многие другие сложные эфиры, это соединение претерпевает конденсацию сложного эфира Клайзена. Преимущество использования этого соединения заключается в том, что предотвращаются нежелательные реакции самоконденсации. Как и другие сложные эфиры, это соединение подвергается бромированию в альфа-положении.
Диэтилмалонат может быть нитрозирован избытком нитрита натрия в уксусной кислоте с получением диэтилоксиминомалоната, каталитический гидрогенолиз которого в этаноле над Pd / C дает диэтиламиномалонат (DEAM). DEAM может быть ацетилирован для получения диэтилацетамидомалоната (полезного в синтезе аминокислот) или может быть добавлен с 3-замещенными 2,4-дикетонами к кипящей уксусной кислоте с получением с максимальным выходом различных замещенных этилпиррол-2-карбоксилатов, представляющих интерес для синтез порфиринов. (См. JB Paine III, D. Dolphin, J. Org. Chem. 1985, 50, 5598-5604.)