 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Малоновая кислота | |
| Предпочтительное название IUPAC Пропандиовая кислота | |
| Другие названия Метандикарбоновая кислота | |
| Идентификаторы | |
| Количество CAS | |
| 3D модель ( JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.005.003 |
| PubChem CID | |
| UNII | |
| Панель управления CompTox ( EPA) | |
ИнЧИ
| |
Улыбки
| |
| Характеристики | |
| Химическая формула | С 3 Н 4 О 4 |
| Молярная масса | 104,061 г моль -1 |
| Плотность | 1,619 г / см 3 |
| Температура плавления | От 135 до 137 ° C (от 275 до 279 ° F; от 408 до 410 K) (разлагается) |
| Точка кипения | разлагается |
| Растворимость в воде | 763 г / л |
| Кислотность (p K a) | рК а1 = 2,83 рК а2 = 5,69 |
| Магнитная восприимчивость (χ) | -46,3 10 −6 см 3 / моль |
| Родственные соединения | |
| Другие анионы | Малонат |
| Родственные карбоновые кислоты | Щавелевая кислота Пропионовая кислота Янтарная кислота Фумаровая кислота |
| Родственные соединения | Малоновый диальдегид диметилмалонат |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
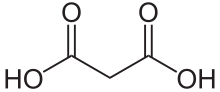
Малоновая кислота ( систематическое название IUPAC : пропандиовая кислота) представляет собой дикарбоновую кислоту со структурой CH 2 (COOH) 2. Ионизируется форма малоновой кислоты, а также его сложных эфиров и солей, известны как малонаты. Например, диэтилмалонат представляет собой диэтиловый эфир малоновой кислоты. Название происходит от греческого слова μᾶλον ( малон), означающего «яблоко».
Малоновая кислота - это натуральное вещество, которое содержится во многих фруктах и овощах. Есть предположение, что цитрусовые, выращенные в органическом сельском хозяйстве, содержат более высокий уровень малоновой кислоты, чем фрукты, выращенные в традиционном сельском хозяйстве.
Малоновая кислота была впервые получена в 1858 году французским химиком Виктором Дессеном путем окисления яблочной кислоты.
Структура была определена с помощью рентгеновской кристаллографии, а обширные данные о свойствах, в том числе для термохимии конденсированной фазы, доступны в Национальном институте стандартов и технологий. Классический препарат малоновой кислоты начинается с хлоруксусной кислоты :
 Получение малоновой кислоты из хлоруксусной кислоты.
Получение малоновой кислоты из хлоруксусной кислоты. Карбонат натрия образует натриевую соль, которая затем реагирует с цианидом натрия с образованием натриевой соли цианоуксусной кислоты посредством нуклеофильного замещения. Нитрила группа может быть гидролизована с гидроксидом натрия до малоната натрия и подкисление дает малоновый кислоту. Однако промышленно малоновую кислоту получают гидролизом диметилмалоната или диэтилмалоната. Он также был произведен путем ферментации глюкозы.
Малоновая кислота реагирует как типичная карбоновая кислота: образуя амидные, сложноэфирные, ангидридные и хлоридные производные. Ангидрид малоновой кислоты можно использовать в качестве промежуточного соединения для производных сложного моноэфира или амида, в то время как малонилхлорид наиболее полезен для получения сложных диэфиров или диамидов. В хорошо известной реакции малоновая кислота конденсируется с мочевиной с образованием барбитуровой кислоты. Малоновая кислота также может конденсироваться с ацетоном с образованием кислоты Мелдрума, универсального промежуточного продукта в дальнейших превращениях. Сложные эфиры малоновой кислоты также используются в качестве - CH 2 COOH синтон в малоновый синтеза сложного эфира.
Кроме того, кофермент А, производное малоната, малонил-КоА, является важным предшественником в биосинтезе жирных кислот наряду с ацетил-КоА. Малонил-КоА образуется из ацетил-КоА под действием ацетил-КоА-карбоксилазы, и малонат переносится на белок-носитель ацила, который добавляется к цепи жирной кислоты.
Малоновая кислота является ключевым компонентом реакции Бриггса – Раушера, классического примера колеблющейся химической реакции.
При конденсации Кневенагеля малоновая кислота или ее диэфиры реагируют с карбонильной группой альдегида или кетона с последующей реакцией дегидратации.
 Z = COOH (малоновая кислота) или Z = COOR '(сложный эфир малоновой кислоты)
Z = COOH (малоновая кислота) или Z = COOR '(сложный эфир малоновой кислоты) Когда используется сама малоновая кислота, это обычно происходит потому, что желаемый продукт представляет собой продукт, в котором произошла вторая стадия с потерей диоксида углерода в так называемой модификации Добнера.
 Модификация Дёбнера конденсации Кневенагеля.
Модификация Дёбнера конденсации Кневенагеля. Так, например, продуктом реакции акролеина и малоновой кислоты в пиридине является транс-2,4-пентадиеновая кислота с одной группой карбоновой кислоты, а не с двумя.
Недокись углерода получают нагреванием сухой смеси пятиокиси фосфора ( P 4О 10) и малоновой кислоты. Он реагирует аналогично малоновому ангидриду с образованием малонатов.
Малоновая кислота является предшественником специальных полиэфиров. Его можно превратить в 1,3-пропандиол для использования в полиэфирах и полимерах, а к 2021 году его объем рынка составит 621,2 миллиона долларов. Он также может входить в состав алкидных смол, которые используются в ряде покрытий для защиты от повреждений. вызванные ультрафиолетовым излучением, окислением и коррозией. Одним из применений малоновой кислоты является промышленность покрытий в качестве сшивающего агента для порошковых покрытий, отверждаемых при низких температурах, которые становятся все более ценными для термочувствительных подложек и стремятся ускорить процесс нанесения покрытий. Мировой рынок покрытий для автомобилей оценивался в 18,59 млрд долларов в 2014 году с прогнозируемыми совокупными годовыми темпами роста до 5,1% до 2022 года.
Он используется в ряде производственных процессов в качестве особо ценного химического вещества, включая электронную промышленность, ароматизаторы и ароматизаторы, специальные растворители, сшивание полимеров и фармацевтическую промышленность. В 2004 году годовое мировое производство малоновой кислоты и связанных с ней диэфиров превышало 20 000 метрических тонн. Потенциальный рост этих рынков может быть результатом достижений промышленной биотехнологии, которая стремится вытеснить химические вещества на нефтяной основе в промышленных применениях.
Министерство энергетики США внесло малоновую кислоту в список 30 основных химических веществ, производимых из биомассы.
В пищевых продуктах и лекарствах малоновая кислота может использоваться для контроля кислотности либо в качестве наполнителя в фармацевтическом составе, либо в качестве натуральной консервантной добавки для пищевых продуктов.
Малоновая кислота используется в качестве строительного химического вещества для производства множества ценных соединений, включая ароматические и ароматические соединения гамма-ноналактон, коричную кислоту и фармацевтическое соединение вальпроат.
Малоновая кислота (до 37,5% масс.) Использовалась для сшивки кукурузного и картофельного крахмалов с целью получения биоразлагаемого термопласта; процесс осуществляется в воде с использованием нетоксичных катализаторов. В 2014 году полимеры на основе крахмала составили 38% мирового рынка биоразлагаемых полимеров, причем пищевая упаковка, упаковка из пеноматериала и мешки для компоста являлись крупнейшими сегментами конечного использования.
Компания Eastman Kodak и другие используют малоновую кислоту и ее производные в качестве хирургического клея.
Малоновый кислота является классическим примером конкурентного ингибитора из фермента сукцинатдегидрогеназы (комплекс II), в дыхательной цепи переноса электронов. Он связывается с активным центром фермента, не вступая в реакцию, конкурируя с обычным субстратом сукцинатом, но не имеет группы -CH 2 CH 2 -, необходимой для дегидрирования. Это наблюдение было использовано для определения структуры активного центра сукцинатдегидрогеназы. Подавление этого фермента снижает клеточное дыхание. Поскольку малоновая кислота является естественным компонентом многих пищевых продуктов, она присутствует у млекопитающих, включая человека.
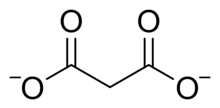 Химическая структура малонатного дианиона.
Химическая структура малонатного дианиона. Малоновая кислота дипротична ; то есть он может отдавать два протона на молекулу. Первый - 2,8, второй - 5,7. Таким образом, малонат- ион может быть H O O C CH 2COO - или C H 2(C O O)2- 2. Малонатные или пропандиоатные соединения включают соли и сложные эфиры малоновой кислоты, такие как