 Связь в диоксиде углерода (CO 2): все атомы окружены 8 электронами, что соответствует правилу октетов .
Связь в диоксиде углерода (CO 2): все атомы окружены 8 электронами, что соответствует правилу октетов .Правило октетов - это химическое эмпирическое правило, которое отражает наблюдение, что элементы основной группы имеют тенденцию связывать таким образом, что каждый атом имеет восемь электронов в своем валентная оболочка, придавая ей ту же электронную конфигурацию, что и благородный газ. Правило особенно применимо к углероду, азоту, кислороду и галогенам, а также к таким металлам, как натрий или магний.
Валентные электроны можно подсчитать с помощью электронной точечной диаграммы Льюиса, как показано справа для диоксида углерода. Электроны, общие для двух атомов в ковалентной связи, подсчитываются дважды, по одному разу для каждого атома. В двуокиси углерода каждый кислород делит четыре электрона с центральным углеродом, два (показаны красным) от самого кислорода и два (показаны черным) от углерода. Все четыре этих электрона подсчитываются как в углеродном, так и в кислородном октете, так что считается, что оба атома подчиняются правилу октета.
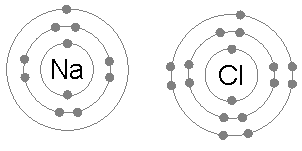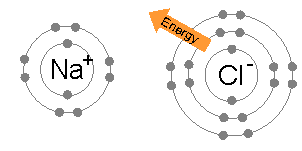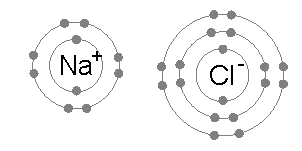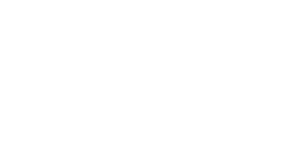
Ионная связь обычна между парами атомов, где один из пар является металлом с низкой электроотрицательностью (например, натрий ) и второй a неметалл с высокой электроотрицательностью (например, хлор ).
У атома хлора семь электронов в своей третьей и внешней электронной оболочке, первая и вторая оболочки заполнены двумя и восемью электронами соответственно. Первое сродство к электрону хлора (выделение энергии, когда хлор получает электрон с образованием Cl) составляет 349 кДж на моль атомов хлора. Добавление второго электрона для образования гипотетического Cl потребует энергии, энергии, которую невозможно восстановить путем образования химической связи. В результате хлор очень часто образует соединение, в котором он имеет восемь электронов на внешней оболочке (полный октет), как в Cl.
У атома натрия есть единственный электрон во внешней электронной оболочке, первая и вторая оболочки снова заполнены двумя и восемью электронами соответственно. Для удаления этого внешнего электрона требуется только первая энергия ионизации, которая составляет +495,8 кДж на моль атомов натрия, небольшое количество энергии. Напротив, второй электрон находится в более глубокой второй электронной оболочке, и вторая энергия ионизации, необходимая для его удаления, намного больше: +4562 кДж на моль. Таким образом, натрий в большинстве случаев образует соединение, в котором он потерял один электрон и имеет полную внешнюю оболочку из восьми электронов, или октета.
Энергия, необходимая для передачи электрона от атома натрия к атому хлора (разница между первой энергией ионизации натрия и сродством к электрону хлора) мала: +495,8 - 349 = +147 кДж моль. Эта энергия легко компенсируется энергией решетки хлорида натрия : -783 кДж моль. Это завершает объяснение правила октетов в данном случае.
 Закон октав Ньюлендса
Закон октав Ньюлендса В 1864 году английский химик Джон Ньюлендс разделил шестьдесят два известных элемента на восемь групп в зависимости от их физических свойств. свойств.
В конце 19 века было известно, что координационные соединения (ранее называвшиеся «молекулярными соединениями») образовывались комбинацией атомов или молекул таким образом, что валентности задействованных атомов, по-видимому, становились довольный. В 1893 году Альфред Вернер показал, что количество атомов или групп, связанных с центральным атомом («координационное число »), часто составляет 4 или 6; другие координационные числа до максимум 8 были известны, но реже. В 1904 году Ричард Абегг был одним из первых, кто расширил понятие координационного числа до концепции валентности, в которой он выделил атомы как доноры или акцепторы электронов., что приводит к состояниям с положительной и отрицательной валентностью, которые очень напоминают современную концепцию состояний окисления. Абегг отметил, что разница между максимальной положительной и отрицательной валентностью элемента в рамках его модели часто составляет восемь. В 1916 году Гилберт Н. Льюис назвал это понимание правилом Абегга и использовал его, чтобы сформулировать свою модель кубического атома и «правило восьми», которые начали различать валентные и валентные электроны. В 1919 году Ирвинг Ленгмюр усовершенствовал эти концепции и переименовал их в «кубический атом октета» и «теорию октета». «Теория октетов» превратилась в то, что теперь известно как «правило октетов».
Вальтер Коссель и Гилберт Н. Льюис увидели, что благородные газы не имеют тенденции принимать участие в химических реакциях в обычных условиях. На основании этого наблюдения они пришли к выводу, что атомы в благородных газов стабильны, и на основе этого заключения они предложили теорию валентности, известную как " электронная теория валентности »в 1916 г.:
Во время образования химической связи атомы объединяются, приобретая, теряя или разделяя электроны таким образом, что они приобретают ближайшую конфигурацию благородного газа.
Квантовая теория атома объясняет восемь электронов как замкнутую оболочку с sp-электронной конфигурацией. Конфигурация с закрытой оболочкой - это конфигурация, в которой нижние энергетические уровни заполнены, а более высокие энергетические уровни пусты. Например, основное состояние атома неона имеет полную оболочку n = 2 (2s 2p) и пустую оболочку n = 3. Согласно правилу октетов, атомы непосредственно перед и после неона в периодической таблице (то есть C, N, O, F, Na, Mg и Al) имеют тенденцию достигать аналогичной конфигурации, приобретая, теряя или разделяя электроны.
Атом аргона имеет аналогичную 3s 3p конфигурацию. Существует также пустой 3d-уровень, но он имеет значительно более высокую энергию, чем 3s и 3p (в отличие от атома водорода), так что 3s 3p по-прежнему считается закрытой оболочкой для химических целей. Атомы непосредственно до и после аргона стремятся достичь этой конфигурации в соединениях. Есть, однако, некоторые из гипервалентных молекулы, в котором может играть определенную роль в связывании 3d-уровень, хотя это спорно (см. Ниже)
Для гелия согласно квантовой теории не существует уровня 1p, так что 1s представляет собой замкнутую оболочку без p-электронов. Атомы до и после гелия (H и Li) следуют правилу дуэта и имеют тенденцию иметь ту же конфигурацию единиц, что и гелий.
Многие реактивные промежуточные продукты нестабильны и не подчиняются правилу октетов. Сюда входят такие виды, как карбены, боран, а также свободные радикалы, такие как метильный радикал (CH 3), который имеет неспаренный электрон на несвязывающей орбитали на атоме углерода и не имеет электронов противоположного спина на той же орбитали. Другим примером является радикал хлора, продуцируемый CFC, который, как известно, вреден для озонового слоя. Эти молекулы часто реагируют так, чтобы завершить свой октет.
Хотя обычно считают, что стабильные молекулы с нечетными электронами и гипервалентные молекулы нарушают правило октетов, ab initio расчеты молекулярных орбиталей показывают, что они в значительной степени подчиняются правилу октетов (см. трехэлектронные связи и гипервалентные молекулы разделы ниже).
 Льюиса и диаграммы МО отдельной связи 2e и связи 3e
Льюиса и диаграммы МО отдельной связи 2e и связи 3e Некоторые стабильные молекулярные радикалы (например, оксид азота, NO) получить конфигурации октетов с помощью трехэлектронной связи, которая вносит один общий и один неподеленный электрон в октет каждого связанного атома. В NO октет на каждом атоме дополняется четырьмя электронами от двух двухэлектронных связей плюс неподеленной парой несвязывающих электронов только на этом атоме. Порядок связи равен 2,5, поскольку каждая двухэлектронная связь считается одной связью, тогда как трехэлектронная связь имеет только один общий электрон и, следовательно, соответствует полусвязи.
Кислород иногда представлен как подчиняющийся правилу октетов с двойной связью (O = O), содержащей две пары общих электронов. Однако основным состоянием этой молекулы является парамагнитный, что указывает на присутствие неспаренных электронов. Полинг предположил, что эта молекула фактически содержит две трехэлектронные связи и одну нормальную ковалентную (двухэлектронную) связь. Октет каждого атома состоит из двух электронов от каждой трехэлектронной связи, плюс два электрона ковалентной связи, плюс одна неподеленная пара несвязывающих электронов. Порядок облигаций равен 1 + 0,5 + 0,5 = 2.
Модифицированные структуры Льюиса со связями 3e оксид азота
оксид азота 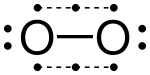 Кислород
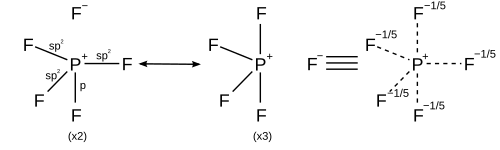
Кислород Элементы основной группы в третьей и последующих строках периодической таблицы могут образовывать гиперкоординаты или гипервалентные молекулы, в которых центральный атом основной группы связан с более чем четырьмя другими атомами, такими как пентафторид фосфора, PF 5 и гексафторид серы, SF 6. Например, в PF 5, если предполагается, что существует пять истинных ковалентных связей, в которых разделяются пять различных электронных пар, тогда фосфор будет окружен 10 валентными электронами в нарушение правила октетов. На заре квантовой механики Полинг предположил, что атомы третьего ряда могут образовывать пять связей, используя одну s, три p и одну d орбитали, или шесть связей, используя одну s, три p и две d орбитали. Чтобы сформировать пять связей, одна s, три p и одна d орбитали объединяются, чтобы сформировать пять spd гибридных орбиталей, каждая из которых имеет общую электронную пару с атомом галогена, в общей сложности 10 общих электронов, на два больше, чем правило октетов предсказывает. Аналогично для образования шести связей, шесть гибридных орбиталей spd образуют шесть связей с 12 общими электронами. В этой модели наличие пустых d-орбиталей используется для объяснения того факта, что атомы третьего ряда, такие как фосфор и сера, могут образовывать более четырех ковалентных связей, тогда как атомы второго ряда, такие как азот и кислород, строго ограничены правилом октетов..
 5 резонансных структур пентафторида фосфора
5 резонансных структур пентафторида фосфора Однако другие модели описывают связывание с использованием только s- и p-орбиталей в соответствии с правилом октетов. В описании валентной связи PF 5 используется резонанс между различными структурами PF 4 F, так что каждый F связан ковалентной связью в четырех структурах и ионная связь в одной структуре. Каждая резонансная структура имеет восемь валентных электронов на P. В описании теории молекулярных орбиталей самая высокая занятая молекулярная орбиталь рассматривается как несвязывающая орбиталь, локализованная на пяти атомах фтора, в дополнение к четыре занятые связывающие орбитали, так что на фосфоре снова всего восемь валентных электронов. Справедливость правила октетов для гипервалентных молекул дополнительно подтверждается расчетами молекулярных орбиталей ab initio, которые показывают, что вклад d-функций в связывающие орбитали невелик.
Тем не менее, для исторических Причины, структуры, предполагающие наличие более восьми электронов вокруг таких элементов, как P, S, Se или I, все еще распространены в учебниках и исследовательских статьях. Несмотря на незначительность расширения d-оболочки для химической связи, эта практика позволяет отображать структуры без использования большого количества формальных зарядов или использования частичных связей и рекомендуется IUPAC в качестве удобного формализма, а не изображений, которые лучше отражают склеивание. С другой стороны, отображение более восьми электронов вокруг Be, B, C, N, O или F (или более двух вокруг H, He или Li) большинством специалистов считается ошибкой.
Правило октетов применимо только к элементам основной группы. Другие элементы подчиняются другим правилам счета электронов, поскольку их конфигурации валентных электронов отличаются от основных элементов группы. Эти другие правила показаны ниже:
| Тип элемента | Первая оболочка | p-block. (Основная группа ) | d-block. (Переходный металл ) |
|---|---|---|---|
| Правила счета электронов | Правило дуэта | Правило октетов | Правило 18-электронов |
| Конфигурация полной валентности | s | sp | dsp |