Правило 18 электронов - это химическое правило thumb используется в основном для прогнозирования и обоснования формул стабильных комплексов переходных металлов, особенно металлоорганических соединений. Правило основано на том факте, что валентные орбитали переходных металлов состоят из пяти d-орбиталей, одной s-орбитали и трех p-орбиталей которые могут коллективно вмещать 18 электронов как связывающих, так и несвязывающих электронных пар. Это означает, что комбинация этих девяти атомных орбиталей с лигандными орбиталями создает девять молекулярных орбиталей, которые либо связываются металл-лиганд, либо не связываются. Когда комплекс металла имеет 18 валентных электронов, считается, что он достиг той же электронной конфигурации, что и благородный газ за период. Правило бесполезно для комплексов металлов, которые не являются переходными металлами, и интересные или полезные комплексы переходных металлов будут нарушать правило из-за последствий отклонения от правила для реакционной способности. Правило было впервые предложено американским химиком Ирвингом Ленгмюром в 1921 году.
Правило успешно предсказывает формулы для низкоспиновых комплексов триад Cr, Mn, Fe и Co. Хорошо известные примеры включают ферроцен, пентакарбонил железа, карбонил хрома и карбонил никеля.
. Лиганды в комплексе определяют применимость 18 -электронное правило. В общем, комплексы, которые подчиняются правилу, состоят, по крайней мере, частично из π-акцепторных лигандов (также известных как π-кислоты). Этот тип лиганда создает очень сильное поле лиганда, которое снижает энергии образующихся молекулярных орбиталей, так что они выгодно заняты. Типичные лиганды включают олефины, фосфины и CO. Комплексы π-кислот обычно содержат металл в низкой степени окисления. Взаимосвязь между степенью окисления и природой лигандов рационализирована в рамках обратного связывания π.
Соединения, которые подчиняются правилу 18-электронов, обычно являются «обменно-инертными». Примеры включают [Co (NH 3)6] Cl 3, Mo (CO) 6 и [Fe (CN) 6] ). В таких случаях обычно обмен лиганда происходит через механизмы диссоциативного замещения, в которых скорость реакции определяется скоростью диссоциации лиганда. С другой стороны, 18-электронные соединения могут быть очень реактивными по отношению к электрофилам, таким как протоны, и такие реакции являются ассоциативными по механизму, являющиеся кислотно-основными реакциями.
Комплексы с менее чем 18 валентными электронами имеют тенденцию проявлять повышенную реакционную способность. Таким образом, правило 18-электронов часто является рецептом отсутствия реакционной способности в любом стехиометрическом или каталитический смысл.
Результаты расчетов показывают, что валентные p-орбитали на металле участвуют в связывании металл-лиганд, хотя и слабо. Однако Вайнхольд и Ландис в контексте естественных связующих орбиталей не учитывает металлические p-орбитали в связи металл-лиганд, хотя эти орбитали все еще включены как поляризация n функций. Это приводит к правилу duodectet (12-электронное) для пяти d-орбиталей и только для одной s-орбитали.
В настоящее время в химическом сообществе принято единодушное мнение о том, что в отличие от правила единственного октета для элементов основной группы, переходные металлы не подчиняются строго правилу 12 или 18 электронов, но правила описывают более низкую граница и верхняя граница количества валентных электронов соответственно. Таким образом, хотя d-орбитальные и s-орбитальные связи переходных металлов возникают легко, участие в связывании более высокоэнергетических и более пространственно диффузных p-орбиталей зависит от центрального атома и координационного окружения.
π-донорные или σ-донорные лиганды с небольшими взаимодействиями с металлическими орбиталями приводят к слабому полю лигандов, которое увеличивает энергии t 2g орбиталей. Эти молекулярные орбитали становятся несвязывающими или слабо антисвязывающими орбиталями (малые Δ oct). Следовательно, добавление или удаление электрона мало влияет на стабильность комплекса. В этом случае нет ограничения на количество d-электронов и возможны комплексы с 12–22 электронами. Малое Δ oct делает возможным заполнение e g * (>18 e), а π-донорные лиганды могут создавать t 2g разрыхление связывания (<18 e). These types of ligand are located in the low-to-medium part of the спектрохимический серия. Например: [TiF 6 ] (Ti (IV), d, 12 e), [Co (NH 3)6] (Co (III), d, 18 e), [Cu ( OH 2)6] (Cu (II), d, 21 e).
Что касается ионов металлов, Δ oct увеличивается вниз по группе, а также с увеличением окисления число. Сильные поля лигандов приводят к низкоспиновым комплексам, которые вызывают некоторые исключения из правила 18 электронов.
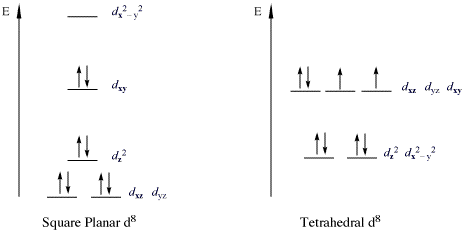
Важный класс комплексов, нарушающих правило 18e, являются 16-электронными комплексами с металлическими d-конфигурациями. Все высокоспиновые d-ионы металлов являются октаэдрическими (или тетраэдрическими ), но все ионы металлов с низкими спинами d являются плоскими квадратными. Важными примерами плоско-квадратных ионов металлов d с низким спином являются Rh (I), Ir (I), Ni (II), Pd (II)) и Pt (II). На рисунке ниже показано расщепление d-подоболочки в низкоспиновых квадратно-плоских комплексах. Примеры: особенно распространены для производных триад кобальта и никеля. Такие соединения обычно являются плоско-квадратными. Самый известный пример - комплекс Васьки (IrCl (CO) (PPh 3)2), [PtCl 4 ] и соль Цейса [PtCl). 3 (η-C 2H4)]. В таких комплексах орбиталь d z занята дважды и не связывается.
Многие каталитические циклы действуют через комплексы, которые чередуются между 18-электронными и квадратно-плоскими 16-электронными конфигурациями. Примеры включают синтез уксусной кислоты Monsanto, гидрирование, гидроформилирование, изомеризацию олефинов и некоторые полимеризации алкенов..
Другие нарушения могут быть классифицированы в соответствии с видами лигандов на металлическом центре.
Объемные лиганды могут препятствовать приближению полного набора лигандов, которые позволит металлу достичь 18-электронной конфигурации. Примеры:
Иногда такие комплексы вступают в агостические взаимодействия с углеводородным каркасом объемного лиганда. Например:
Высокоспиновые комплексы металлов имеют однократно занятые орбитали и могут не иметь пустых орбиталей, в которые лиганды могли бы отдавать электронную плотность. Как правило, в комплексе мало или совсем нет π-кислотных лигандов. Эти однократно занятые орбитали могут объединяться с отдельными занятые орбитали радикальных лигандов (например, кислород ) или добавление лиганда сильного поля может вызвать спаривание электронов, создавая, таким образом, вакантную орбиталь, на которую он может отдавать. Примеры:
Комплексы, содержащие сильно π-донорный лиганд часто нарушают правило 18 электронов. Эти лиганды включают фторид (F), оксид (O), нитрид (N), алкоксиды (RO) и имиды (RN). Примеры:
В последнем случае имеется значительное пожертвование неподеленные пары азота с Мо (так что соединение можно также описать как соединение 16e). Это видно по короткой длине связи Mo – N и по углу Mo – N – C (R), который составляет около 180 °. Контрпримеры:
В этих случаях связи M = O представляют собой "чистые" двойные связи (т.е. отсутствие передачи неподеленных пар кислорода металлу), что отражено в относительно длинной связи расстояния.
Лиганды, в которых координирующий атом несет несвязывающие неподеленные пары, часто стабилизируют ненасыщенные комплексы. Амиды и алкоксиды металлов часто нарушают правило 18e
Вышеуказанные факторы иногда могут сочетаться. Примеры включают
Некоторые комплексы имеют более 18 электронов. Примеры:
Часто случаи, когда комплексы имеют более 18 валентных электронов связаны с электростатическими силами - металл притягивает лига стремится к себе, чтобы попытаться уравновесить свой положительный заряд, и количество электронов, которыми он заканчивает, неважно. В случае металлоценов хелатирующая природа циклопентадиенильного лиганда стабилизирует его связывание с металлом. В некоторой степени удовлетворительными являются два следующих наблюдения: кобальтоцен является сильным донором электронов, легко образуя 18-электронный катион кобальтоцения; и никелоцен имеет тенденцию реагировать с субстратами с образованием 18-электронных комплексов, например CpNiCl (PR 3) и свободный CpH.
В случае никелоцена дополнительные два электрона находятся на орбиталях, которые слабо разрыхляют металл-углерод; именно поэтому он часто участвует в реакциях, в которых связи M – C разрываются, и счетчик электронов металла изменяется до 18.
20-электронные системы TM (CO) 8 ( TM = Sc, Y, La) имеют кубическую (O h) равновесную геометрию и синглетное (A 1g) основное электронное состояние. Имеется одна занятая валентная МО с симметрией 2u, которая образована только орбиталями лигандов без вклада металлических АО. Но аддукты TM (CO) 8 (TM = Sc, Y, La) удовлетворяют правилу 18-электронов, если рассматривать только те валентные электроны, которые занимают связывающие орбитали металл – лиганд.