| Перенос эмбриона 123 | |
|---|---|
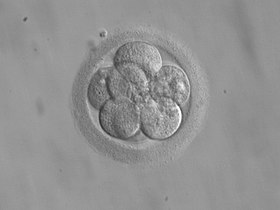 8-клеточный эмбрион для переноса через 3 дня после оплодотворения 8-клеточный эмбрион для переноса через 3 дня после оплодотворения | |
| MeSH | D004624 |
| [редактировать в Викиданных ] | |
Перенос эмбрионов относится к этапу процесса вспомогательной репродукции, на котором эмбрионы помещаются в матку самки с намерением установить беременность. Этот метод (который часто используется в связи с экстракорпоральным оплодотворением (ЭКО)) может применяться на людях или животных, в которых цели могут быть разными.
Перенос эмбрионов может быть осуществлен на второй или третий день или позже на стадии бластоцисты, которая впервые была проведена в 1984 году.
Эмбрионы могут быть либо «свежими» из оплодотворенных яйцеклеток того же менструального цикла, либо «замороженными», то есть они были созданы в предыдущем цикле и подверглись криоконсервации эмбрионов и разморозили непосредственно перед переносом, что в дальнейшем называется «перенос замороженных эмбрионов» (FET). Результат использования криоконсервированных эмбрионов всегда был положительным без увеличения врожденных дефектов или аномалий развития, также между свежими и замороженными яйцами, использованными для интрацитоплазматической инъекции сперматозоидов (ИКСИ). Фактически, частота наступления беременности увеличивается после FET, и перинатальные исходы страдают меньше, по сравнению с переносом эмбриона в том же цикле, в котором выполнялась гиперстимуляция яичников. Считается, что эндометрий не оптимально подготовлен для имплантации после гиперстимуляции яичников, и поэтому перенос замороженного эмбриона можно использовать в отдельном цикле, чтобы сосредоточиться на оптимизации шансов на успешную имплантацию. Дети, рожденные от застеклованных бластоцист, имеют значительно более высокий вес при рождении, чем дети, рожденные от незамороженных бластоцист. При переносе замороженного-размороженного ооцита вероятность наступления беременности практически одинакова, независимо от того, переносится ли он в естественном цикле или в цикле с индукцией овуляции.
С точки зрения переносимости FET и свежих эмбрионов, вероятно, мало или нет разницы. рождаемости; однако FET может снизить риск синдрома гиперстимуляции яичников и в то же время повысить риск осложнений беременности.
У человека Выстилка матки (эндометрий ) должна быть соответствующим образом подготовлена, чтобы эмбрион (ы) мог имплантироваться. В естественном цикле перенос эмбриона происходит в лютеиновой фазе, в то время, когда слизистая оболочка недостаточно развита по сравнению со статусом лютеинизирующего гормона. В стимулированном или в цикле, когда переносится «замороженный» эмбрион, женщине-реципиенту могут быть даны сначала препараты эстрогена (около 2 недель), затем комбинация эстрогена и прогестерона, поэтому что подкладка становится восприимчивой к зародышу. Время восприятия - это окно имплантации. В научном обзоре в 2013 г. был сделан вывод, что невозможно определить один метод подготовки эндометрия при переносе замороженных эмбрионов как более эффективный, чем другой.
Ограниченные данные также подтверждают удаление цервикальная слизь перед переносом.
Перенос эмбриона может быть выполнен после различной продолжительности культивирования эмбриона, что соответствует различным стадиям эмбриогенеза. Основными этапами, на которых выполняется перенос эмбрионов, являются этап дробления (дни 2-4 после совместной инкубации ) или этап бластоцисты (день 5 или 6 после совместная инкубация ).
Эмбрионы, достигшие клеточной стадии 3 дня, могут быть проверены на хромосомные или специфические генетические дефекты перед возможным переносом с помощью преимплантационной генетической диагностики (PGD). Перенос на стадии бластоцисты дает значительное увеличение коэффициента живорождения на перенос, но также означает уменьшение количества эмбрионов, доступных для переноса, и криоконсервацию эмбрионов, поэтому совокупная частота клинических беременностей увеличивается с переносом стадии дробления. Неизвестно, есть ли разница в коэффициенте живорождения между переносом на второй или третий день после оплодотворения.
Монозиготное двойникование не увеличивается после переноса бластоцисты по сравнению с расщеплением - стадия эмбриона перенос.
Существует значительно более высокая вероятность предварительной срочные роды (отношение шансов 1,3) и врожденные аномалии (отношение шансов 1,3) среди рождений, достигших стадии бластоцисты по сравнению со стадией дробления. Из-за повышенной смертности женских эмбрионов из-за эпигенетических модификаций, вызванных расширенным культивированием, перенос бластоцисты приводит к большему количеству рождений мужского пола (56,1% мужчин) по сравнению с переносом через 2 или 3 дня (нормальное соотношение полов 51,5% мужчин).
Лаборатории разработали методы классификации для оценки качества ооцитов и эмбрионов. Для оптимизации частоты наступления беременности существуют убедительные доказательства того, что морфологическая балльная система является наилучшей стратегией отбора эмбрионов. С 2009 года, когда первая система покадровой микроскопии для ЭКО была одобрена для клинического использования, морфокинетические системы оценки показали дальнейшее улучшение до частоты наступления беременности. Однако, когда все различные типы устройств для покадровой визуализации эмбрионов, с морфокинетическими системами оценки или без них, сравниваются с традиционной оценкой эмбрионов для ЭКО, нет достаточных доказательств различий в живорождении, беременности, мертворождение или выкидыш на выбор. Небольшое проспективное рандомизированное исследование, проведенное в 2016 году, сообщило о более низком качестве эмбрионов и большем количестве времени персонала на автоматическом устройстве для покадровой визуализации эмбрионов по сравнению с традиционной эмбриологией. Активные усилия по разработке более точного анализа отбора эмбрионов на основе искусственного интеллекта и глубокого обучения продолжаются. Алгоритм интеллектуальной классификации ранжирования эмбрионов (ERICA) является ярким примером. Это программное обеспечение для глубокого обучения заменяет ручную классификацию системой ранжирования, основанной на прогнозируемом генетическом статусе отдельного эмбриона неинвазивным способом. Исследования в этой области еще не завершены, и текущие технико-экономические обоснования подтверждают его потенциал.
Процедура переноса эмбриона начинается с помещения расширителя во влагалище для визуализации шейки матки, которую очищают физиологическим раствором. раствор или питательные среды. В мягкий катетер для переноса загружают эмбрионы и передают врачу после подтверждения личности пациента. Катетер вводится через цервикальный канал и продвигается в полость матки.
Имеются убедительные и убедительные доказательства пользы от ультразвукового контроля, то есть проведения УЗИ брюшной полости для обеспечения правильного размещения, что составляет 1-2 см от дна матки. Имеются данные о значительном увеличении клинической беременности при использовании ультразвукового контроля по сравнению с использованием только «клинического прикосновения». Анестезия обычно не требуется. В частности, перенос одиночных эмбрионов требует аккуратности и аккуратности при размещении в полости матки. Оптимальная цель для размещения эмбриона, известная как точка максимального потенциала имплантации (MIP), определяется с помощью 3D / 4D ультразвука. Однако существует ограниченное количество доказательств, подтверждающих отложение эмбрионов в средней части матки.
После введения катетера содержимое изгоняется, а эмбрионы откладываются. Ограниченные доказательства подтверждают возможность пробного переноса до проведения процедуры с эмбрионами. После изгнания продолжительность нахождения катетера внутри матки не влияет на частоту наступления беременности. Ограниченные данные позволяют избежать отрицательного давления в катетере после изгнания. После извлечения катетер передается эмбриологу, который осматривает его на предмет оставшихся эмбрионов.
В процессе переноса зиготы внутрь фаллопия (ZIFT) яйцеклетки удаляются из женщины, оплодотворяются, а затем помещаются в маточные трубы женщины, а не в матку.
В 2015 году Американское общество репродуктивной медицины разработало медицинское моделирование процедуры переноса эмбрионов со швейцарской компанией, предназначенное для образование и подготовка клиницистов. Симулятор виртуальной реальности, который включает моделирование в реальном времени ультразвукового контроля, был представлен на ежегодной конференции Американского общества репродуктивной медицины.
Основная проблема заключается в том, сколько эмбрионов следует перенести, поскольку размещение нескольких эмбрионов сопряжено с риском многоплодной беременности. В то время как раньше врачи помещали несколько эмбрионов, чтобы увеличить шанс беременности, этот подход уже не пользуется популярностью. Профессиональные общества и законодательные органы многих стран издали руководящие принципы или законы, ограничивающие эту практику. Подходящее количество эмбрионов для переноса зависит от возраста женщины, от того, будет ли это первая, вторая или третья попытка полного цикла ЭКО, а также от наличия высококачественных эмбрионов. Согласно руководству Национального института здравоохранения и качества ухода (NICE) от 2013 года, количество эмбрионов, переносимых за цикл, следует выбирать, как показано в следующей таблице:
| Возраст | Попытка № | Перенесенные эмбрионы |
|---|---|---|
| <37 years | 1-й | 1 |
| 2-й | 1, если высшего качества | |
| 3-й | Не более 2 | |
| 37– 39 лет | 1-е и 2-е | 1, если высокое качество |
| 2, если нет высшего качества | ||
| 3-е | Не более 2 | |
| 40– 42 года | 2 |
Техника выбора только одного эмбриона для передачи женщине называется выборочный перенос одного эмбриона (e-SET ) или, когда эмбрионы находятся на стадии бластоцисты, это также можно назвать выборочным переносом одиночной бластоцисты (eSBT). Это значительно снижает риск многоплодной беременности по сравнению, например, с Двойной перенос эмбриона (DET) или двойной перенос бластоцисты (2BT) с коэффициентом двойникования примерно 3,5% в sET по сравнению с примерно 38% в DET или 2% в eSBT по сравнению с примерно 25% в 2BT. В то же время частота беременностей при использовании eSBT не намного меньше, чем при использовании 2BT. То есть совокупный коэффициент живорождения, связанный с переносом одного свежего эмбриона с последующим переносом одного замороженного и размороженного эмбриона, сопоставим с таковым после одного цикла двойного переноса свежих эмбрионов. Кроме того, SET имеет лучшие результаты с точки зрения среднего гестационного возраста при родах, способа родоразрешения, массы тела при рождении и риска необходимости неонатальной интенсивной терапии, чем DET. e-SET эмбрионов на стадии дробления снижает вероятность живорождения на 38% и многоплодия на 94%. Данные рандомизированных контролируемых испытаний показывают, что увеличение количества попыток e-SET (свежих и / или замороженных) приводит к кумулятивному коэффициенту живорождения, аналогичному таковому при DET.
Использование переноса одного эмбриона является самым высоким в Швеции (69,4%), но всего 2,8% в США. Доступ к государственному финансированию АРТ, наличие хороших помещений для криоконсервации, эффективное просвещение о рисках многоплодной беременности и законодательство, по-видимому, являются наиболее важными факторами для регионального использования переноса одиночных эмбрионов. Кроме того, личный выбор играет значительную роль, так как многие субфертильные пары сильно отдают предпочтение близнецам.
Неизвестно, принесло ли применение механическое закрытие цервикального канала после переноса эмбриона. любой эффект.
Будет ли женщина лежать в течение определенного времени после переноса эмбриона, может иметь небольшое значение или не иметь никакого значения.
Использование гиалуроновой кислоты в качестве приверженности среда для эмбриона может повысить рождаемость. Заполнение мочевого пузыря, удаление цервикальной слизи или промывание эндометрия или эндоцервикальной полости во время переноса эмбриона могут быть незначительными или полезными. Дополнительные антибиотики в виде амоксициллина плюс клавулановая кислота, вероятно, не увеличивают частоту клинической беременности по сравнению с отсутствием антибиотиков.
Для переноса замороженных-размороженных эмбрионов или переноса эмбрионов эмбриона от донорства яйцеклеток, реципиенту не требуется предыдущая гиперстимуляция яичников, что может выполняться в спонтанных овуляторных циклах. Тем не менее, существуют различные протоколы для переноса замороженных-размороженных эмбрионов, такие как протоколы с гиперстимуляцией яичников, протоколы, в которых эндометрий искусственно подготавливается с помощью эстрогена и / или прогестерона.. Имеются некоторые свидетельства того, что в циклах, когда эндометрий искусственно подготавливается эстрогеном или прогестероном, может быть полезным введение дополнительного препарата, подавляющего выработку гормона яичниками, например, непрерывное введение агониста гонадотропин-рилизинг-гормона (ГнРГ). Для донорства яйцеклеток существуют доказательства более низкой частоты наступления беременности и более высокой частоты отмены цикла, когда прием прогестерона у реципиента начинается до получения ооцитов у донора, по сравнению с в день начала сбора ооцитов или на следующий день.
Семенная жидкость содержит несколько белков, которые взаимодействуют с эпителиальными клетками шейки матки и матки, вызывая активную гестационную иммунная толерантность. Значительно улучшаются результаты, когда женщины подвергаются воздействию семенной плазмы примерно во время переноса эмбриона, со статистической значимостью для текущей беременности, но не для коэффициентов живорождений при ограниченных доступных данных.
Пациенты обычно начинают прием прогестерона после извлечения яйцеклеток (также называемых ооцитами). В то время как ежедневные внутримышечные инъекции прогестерона в масле (PIO) были стандартным способом введения, инъекции PIO не одобрены FDA для использования во время беременности. Недавний метаанализ показал, что внутривлагалищный путь введения с соответствующей дозой и частотой дозирования эквивалентен ежедневным внутримышечным инъекциям. Кроме того, недавнее сопоставленное исследование, в котором сравнивали вагинальный прогестерон с инъекциями PIO, показало, что показатели живорождения были почти идентичны при использовании обоих методов. Продолжительность введения прогестерона в 11 дней приводит к почти такой же частоте рождаемости, чем при более длительной.
В некоторых случаях после переноса эмбриона пациентам также назначают препараты эстрогена. Тест на беременность обычно проводится через две недели после извлечения яйцеклетки.
Необязательно, чтобы перенос эмбриона выполнялся самке, которая предоставила яйца. Таким образом, другая самка, чья матка подготовлена соответствующим образом, может получить эмбрион и забеременеть. Перенос эмбриона может быть использован, если женщина имеет яйцеклетки, но не имеет матки и хочет иметь биологического ребенка; ей потребуется помощь гестационного носителя или суррогатной матери для вынашивания беременности. Кроме того, женщина, у которой нет яйцеклеток, но есть матка, может использовать донор яйцеклеток ЭКО, и в этом случае другая женщина предоставит яйцеклетки для оплодотворения, и полученные эмбрионы помещаются в матку пациентки. Оплодотворение может быть выполнено с использованием спермы партнера женщины или донорской спермы. «Запасные» эмбрионы, созданные для другой пары, проходящей лечение ЭКО, но которые затем являются избыточными для потребностей этой пары, также могут быть перенесены (так называемое донорство эмбрионов ). Эмбрионы могут быть специально созданы с использованием яйцеклеток и спермы доноров, а затем их можно перенести в матку другой женщины. Суррогатная мать может вынашивать ребенка, рожденного путем переноса эмбриона для другой пары, даже если ни она, ни пара, «вводящая в эксплуатацию», биологически не связаны с ребенком. Третья сторона воспроизводство является спорным и регулируются во многих странах. Лица, вступающие в соглашение о суррогатном материнстве, должны понимать совершенно новый тип отношений, который не соответствует ни одному из традиционных сценариев, которые мы используем для классификации отношений как родства, дружбы, романтического партнерства или рыночных отношений. У суррогатных матерей есть опыт вынашивания ребенка, которого они воспринимают как не своего родственника, в то время как предполагаемые матери имеют опыт ожидания в течение девяти месяцев беременности и перехода к материнству вне тела беременной. Это может привести к новым представлениям о теле и себе.
Первый перенос эмбриона от одного человека к другому, приведший к беременности, был зарегистрирован в июле 1983 года и впоследствии привел к объявлению первое человеческое рождение 3 февраля 1984 г. Эта процедура была проведена в медицинском центре Harbour UCLA под руководством доктора Джона Бастера и Калифорнийского университета в Медицинской школе Лос-Анджелеса.
В ходе процедуры эмбрион, который только начинал развиваться, был передан от одной женщины, у которой он был зачат в результате искусственного оплодотворения, другой женщине, которая родила ребенка 38 неделями позже.. Сперма, использованная при искусственном оплодотворении, поступила от мужа женщины, которая вынашивала ребенка.
Этот научный прорыв установил стандарты и стал фактором изменений для женщин, страдающих бесплодием, и для женщин, которые не страдали от бесплодия. хотят передать своим детям генетические нарушения. Перенос донорских эмбрионов дал женщинам механизм, позволяющий забеременеть и родить ребенка, который будет содержать генетический код их мужа. Хотя практика переноса донорского эмбриона произошла от первоначального нехирургического метода, в настоящее время на него приходится около 5% зарегистрированных рождений при экстракорпоральном оплодотворении.
До этого тысячи женщин, которые были бесплодны, имели усыновление как единственный путь к отцовству. Это подготовило почву для открытого и откровенного обсуждения донорства и переноса эмбрионов. Этот прорыв уступил место распространенной практике донорства человеческих эмбрионов, аналогичной другим видам донорства, таким как донорство крови и основных органов. Во время этого объявления событие было освещено основными носителями новостей и вызвало здоровые дебаты и обсуждения этой практики, которая повлияла на будущее репродуктивной медицины, создав платформу для дальнейшего улучшения здоровья женщин.
Эта работа установила техническую основу и юридико-этическую основу для клинического использования ооцитов и донорства эмбрионов, основной клинической практики, которая развивалась за за последние 25 лет.
Кокрановский систематический обзор, обновленный в 2012 году, показал, что перенос стадии бластоцисты более эффективен, чем перенос стадии расщепления (2-й или 3-й день) при вспомогательных репродуктивных технологиях. Он показал небольшое улучшение коэффициента живорождения на пару при переносе бластоцисты. Это означало бы, что для типичного показателя 31% в клиниках, использующих циклы ранних стадий дробления, показатель увеличился бы до 32–42% живорождений, если бы клиники использовали перенос бластоцисты.
 Перенесенный эмбрион телята шароле с их матерями-реципиентами ангус и герефорд.
Перенесенный эмбрион телята шароле с их матерями-реципиентами ангус и герефорд. Методы переноса эмбрионов позволяют высококачественным самкам поголовье иметь большее влияние на генетические продвижение стада во многом аналогично тому, как искусственное осеменение позволило более широко использовать лучших производителей. ET также позволяет продолжать использовать животных, таких как соревновательные кобылы, для продолжения дрессировки и показа, производя жеребят. Общие эпидемиологические аспекты переноса эмбрионов показывают, что перенос эмбрионов дает возможность внедрить генетический материал в популяции домашнего скота, при этом значительно снижая риск передачи инфекционных заболеваний. Недавние разработки в области определения пола эмбрионов перед переносом и имплантацией имеют большой потенциал в молочной и других отраслях животноводства.
Перенос эмбрионов также используется лабораторным мышам. Например, эмбрионы генетически модифицированных штаммов, которые трудно разводить или содержать дорого, можно хранить в замороженном виде и только размораживать и имплантировать в псевдобеременную самку при необходимости.
19 февраля 2020 года в зоопарке Колумбуса в Огайо родилась первая пара детенышей гепарда, зачатая путем переноса эмбрионов от суррогатной матери гепарда.
 Эмбрионы крупного рогатого скота in vitro.
Эмбрионы крупного рогатого скота in vitro. Разработка различных методов криоконсервации эмбрионов крупного рогатого скота значительно улучшила технику переноса эмбрионов, более не зависящую от немедленная готовность подходящих получателей. Частота наступления беременности немного ниже, чем у свежих эмбрионов. В последнее время использование криопротекторов, таких как этиленгликоль, позволило осуществить прямой перенос эмбрионов крупного рогатого скота. Первый в мире гибридный теленок крупного рогатого скота, полученный в тропических условиях путем прямого переноса (DT) эмбриона , замороженного в среде замораживания этиленгликоля, родился 23 июня 1996 года. Д-р Биной Себастьян Веттикаль из Kerala Livestock Development Board Ltd произвел эмбрион, который хранился замороженным в среде для замораживания этиленгликоля с помощью метода медленного программируемого замораживания (SPF), и сразу же после этого передавался реципиенту скоту размораживание замороженной соломы в воде для рождения этого теленка. В исследовании, полученные in vivo кроссбредные эмбрионы крупного рогатого скота, хранящиеся в замороженной среде с этиленгликолем, были перенесены непосредственно реципиентам в тропических условиях, и процент наступления беременности составил 50 процентов. В обзоре индустрии переноса эмбрионов в Северной Америке показатели успешности переноса эмбрионов при прямом переносе эмбрионов были такими же высокими, как и при использовании глицерина. Более того, в 2011 году более 95% замороженных-размороженных эмбрионов были перенесены с помощью прямого переноса.