 Лестницы окисления, подобные этой, используются для иллюстрации последовательностей карбонилов, которые могут взаимно превращаться в результате окисления или восстановления.
Лестницы окисления, подобные этой, используются для иллюстрации последовательностей карбонилов, которые могут взаимно превращаться в результате окисления или восстановления. In органическая химия, восстановление карбонила - это органическое восстановление любой карбонильной группы с помощью восстановителя.
Типичными карбонильными соединениями являются кетоны, альдегиды, карбоновые кислоты, сложные эфиры и галогенангидриды. карбоновые кислоты, сложные эфиры и кислоты галогениды могут быть восстановлены либо до альдегидов, либо на последующей стадии до первичных спиртов, в зависимости от концентрации восстанавливающего агента; альдегиды и кетоны могут быть восстановлены соответственно до первичных и вторичных спиртов. В деоксигенации спирт может быть дополнительно восстановлен и полностью удален.
Гидриды металлов на основе бора и алюминия являются обычными восстановителями; каталитическое гидрирование также является важным методом восстановления карбонилов. До открытия растворимых гидридных реагентов, сложные эфиры восстанавливали с помощью восстановления Буво-Блана, используя смесь металлического натрия в присутствии спиртов.
Механизм реакции для гидрида металла восстановление основано на нуклеофильном присоединении гидрида к карбонильному углероду. В некоторых случаях катион щелочного металла, особенно Li, активирует карбонильную группу за счет координации с кислородом карбонила, тем самым повышая электрофильность карбонила.
Для восстановления производных карбоновой кислоты после восстановления ионом гидрида алюминия удаление приводит к альдегидному продукту (который может быть восстановлен во второй раз до спирта):

Для восстановления альдегидов и кетонов ион гидрида алюминия восстанавливает соединение с образованием соли алкоксида. После полного восстановления алкоксид протонируется с образованием спиртового продукта:

 Резонансные структуры различных карбонилов, упорядоченные от наиболее стабильных (наименее реактивных) до наименее стабильных (наиболее реактивных)
Резонансные структуры различных карбонилов, упорядоченные от наиболее стабильных (наименее реактивных) до наименее стабильных (наиболее реактивных) Кетоны менее реакционноспособны, чем альдегиды, из-за больших стерических эффектов и потому, что дополнительная алкильная группа может передавать электронную плотность частичному положительному заряду полярной связи C = O. Следовательно, альдегиды восстанавливаются легче, чем кетоны, и требуют более мягких реагентов и более мягких условий. Карбоновые кислоты и сложные эфиры дополнительно стабилизируются присутствием второго атома кислорода, который может отдавать неподеленную пару в уже полярную связь C = O. Ацилгалогениды являются наименее стабильными из карбонилов, поскольку галогениды являются плохими донорами электронов, а также большими уходящими группами.
. Результатом этих тенденций в реакционной способности карбонила является то, что галогенангидриды, кетоны и альдегиды обычно являются наиболее легко восстанавливаемыми соединениями, тогда как кислоты и сложные эфиры требуют более сильного восстановления.
Четыре основных фактора влияют на силу восстановителей гидрида металла. Во-первых, способность противоиона активировать карбонилы зависит от того, насколько хорошо он может координироваться с кислородом карбонила. Литий меньше и более электрофилен, чем натрий, поэтому он гораздо сильнее координирует свои действия и больше активирует карбонил. Металлы, которые могут иметь несколько зарядов (такие как Mg, Al и Zn), образуют катионы с высокой плотностью заряда и, следовательно, также являются более сильными активаторами, чем Na.
Во-вторых, центральный металл может влиять на прочность восстановителя. Алюминий крупнее бора, поэтому он слабее связывается с гидридами, которые более подвержены атакам; поэтому гидриды алюминия являются лучшими восстановителями, чем боргидриды. Третий фактор, стерильность, делает некоторые замещенные гидриды (гидриды, в которых один или несколько гидридов заменены заместителями) гораздо более слабыми восстановителями, чем гидриды других металлов: триацетоксиборгидрид натрия (NaBH (OAc) 3), например, можно использовать для селективного восстановления альдегидов и оставить менее реакционноспособные кетоны непрореагировавшими.
Наконец, заместители могут иметь другие эффекты на реакционную способность восстанавливающего агента: ацетоксигруппы препятствуют восстановительной способности NaBH (OAc) 3 не только из-за стерического объема, но также потому, что они акцептируют электроны. Цианогруппы также препятствуют восстановлению агентов, в то время как электронодонорные группы, такие как алкильные группы, могут их улучшать, например, в супергидриде (триэтилборгидрид лития), который является достаточно сильным нуклеофилом для предотвращения нежелательного перестановки при редукции.
Из-за этих эффектов заместителей NaBH 3 CN является очень плохим восстановителем при умеренном pH (>4), поэтому он предпочитает восстановительное аминирование восстановлению карбонила, как показано ниже:
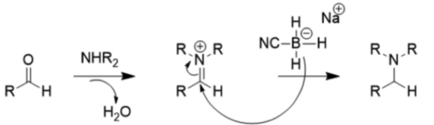
Относительно слабый восстановитель боргидрид натрия обычно используется для восстановления кетонов и альдегидов, потому что в отличие от литийалюмогидрида он допускает использование многих функциональных групп (нитрогруппы, нитрила, сложного эфира) и может использоваться с водой или этанолом в качестве растворителей. Литийалюминийгидрид и другие сильные восстановители, такие как диизобутилалюминийгидрид, L-селектрид, диборан, диазен и алюмогидрид, также могут восстанавливать альдегиды и кетоны, но не являются предпочтительными, поскольку они опасны и обладают высокой реакционной способностью. Однако эти соединения полезны для восстановления карбоновых кислот и сложных эфиров до спиртов, поскольку боргидрид натрия недостаточно мощный для этого.
В следующей таблице показано, какие карбонильные функциональные группы могут быть восстановлены с помощью восстанавливающих агентов (некоторые из этих реагентов различаются по эффективности в зависимости от условий реакции):

Образование альдегидов из производных карбоновых кислот часто является проблемой, потому что более слабые восстанавливающие агенты (NaBH 4) неспособны восстанавливать сложные эфиры и карбоновые кислоты, которые относительно стабильны, а более сильные восстанавливающие агенты (LiAlH 4) немедленно восстанавливают образованный альдегид до спирта.
Поскольку хлорангидриды менее стабильны, чем альдегиды и кетоны, их часто используют в сочетании со стерически затрудненными донорами ангидрида при синтезе альдегиды, потому что относительно слабый восстановитель будет реагировать предпочтительно с исходным хлорангидридом, оставляя альдегидный продукт непрореагировавшим. Для этой цели часто используется восстановитель DIBAL-H (гидрид диизобутилалюминия): хотя он обычно восстанавливает все карбонилы, он может прекратить восстановление по альдегиду, если используется только один эквивалент при низких температурах. LiAl (OtBu) 3 (образованный из LiAlH 4 и tBuOH in situ) также может останавливать восстановление альдегида посредством механизма, аналогичного DIBAL-H.
Традиционный метод образования альдегидов без восстановления до спиртов - с использованием затрудненных гидридов и реакционноспособных карбонилов - ограничен его узким объемом субстрата и большой зависимостью от условий реакции. Один из способов избежать этого метода - полностью восстановить производное карбоновой кислоты до спирта, а затем снова окислить спирт до альдегида. Другие альтернативы включают образование сложного тиоэфира или амида Вайнреба, затем восстановление новых частиц до альдегида посредством восстановления Фукуямы или реакции Вайнреба, соответственно, или с использованием каталитического гидрирования, как в реакции Розенмунда.
 Превращение в тиоэфир с последующим восстановлением по Фукуяме
Превращение в тиоэфир с последующим восстановлением по Фукуяме В восстановлении по Фукуяме карбоновая кислота сначала превращается в тиоэфир путем добавления тиола (с механизмом, аналогичным этерификации ). Затем сложный тиоэфир восстанавливают до альдегида силилгидридом с палладиевым катализатором.
В реакции Вайнреба ацилхлорид сначала превращается в амид Вайнреба, затем обрабатывается металлоорганическим реагентом с образованием кетона или алюмогидрида лития с образованием альдегида:

Амид Вайнреба восстанавливается с помощью стабильного хелата, а не электрофильного карбонила, который образуется в результате восстановления гидрида металла; поэтому хелат восстанавливается только один раз, как показано ниже:

Реакция Розенмунда восстанавливает ацилхлориды до альдегидов с использованием газообразного водорода с катализатором палладий на сульфате бария, небольшая площадь поверхности которого предотвращает избыточное восстановление.
 Механизм восстановления Вольфа-Кишнера
Механизм восстановления Вольфа-Кишнера Альдегиды и кетоны могут быть восстановлены не только до спиртов, но и до алканов. Некоторые реакции для этого превращения включают восстановление Клемменсена (в сильнокислых условиях) и восстановление Вольфа-Кишнера (в сильно основных условиях), а также различные модификации реакция Вольфа-Кишнера. В модификации Калиоти, например, используется тозилгидразон с донором гидрида в более мягких условиях без основания; модификация Майерса заменяет гидразин бис (трет-бутилдиметилсилил) -гидразином, использует более мягкие условия при комнатной температуре и является быстрой и эффективной.
 Примеры енона и эналя
Примеры енона и эналя В α, β-восстановление (также называемое конъюгатное восстановление ) субстрат представляет собой α, β-ненасыщенный карбонил, енон или енал.
Когда эти субстраты восстанавливаются, 1,2-восстановление, которое дает аллиловый спирт, конкурирует с 1,4-восстановлением, которое образует насыщенный кетон или альдегид. Следующее восстановление енона NaBH 4 показывает два возможных продукта: первый из 1,4-восстановления, а второй из 1,2-восстановления.

Чем более стерически затруднен еноновый субстрат, тем больше наверно 1,2 уменьшение делается. Кроме того, для селективного образования спирта и исключения продукта 1,4 в реакции Люше используется меньшая молекула Ce (BH 4)3(полученная из NaBH 4 и CeCl 3 объединены in situ) в качестве источника гидрида.
Источник гидрида Zn (BH 4)2также демонстрирует 1,2-селективность, а также более высокую диастереоселективность; он делает это путем координации не только с карбонильный кислород, но также и соседние атомы:

При восстановлении циклогексанонов источник гидрида может атаковать аксиально с образованием экваториального спирта, или экваториально для образования аксиального спирта. При осевом воздействии (показано красным) гидрид сталкивается с 1,3-диаксиальной деформацией. При экваториальном воздействии (показан синим) гидрид позволяет избежать 1,3-диаксиального взаимодействия, но субстрат подвергается неблагоприятной деформации кручения, когда вновь образованный спирт и добавленный атом водорода затмевают друг друга в промежуточном продукте реакции (как показано в t проекция Ньюмана для аксиального спирта).

Большие восстановители, такие как LiBH (Me 2 CHCHMe) 3, задерживаются 1,3-осевыми взаимодействиями и поэтому атакуют экваториально. Небольшие восстановители, такие как NaBH 4, предпочтительно атакуют в осевом направлении, чтобы избежать затменных взаимодействий, поскольку 1,3-диаксиальное взаимодействие для малых молекул минимально; Стереоэлектронные причины также приводились в пользу осевого предпочтения небольших восстановителей. Однако увеличение объема субстрата (и усиление 1,3-осевого взаимодействия) снижает распространенность аксиальных атак даже для небольших доноров гидридов.
Когда асимметричные кетоны уменьшаются, образующийся вторичный спирт имеет хиральный центр, которым можно управлять с помощью хиральных катализаторов.
Хорошо известными карбонильными восстановлениями в асимметричном синтезе являются асимметричное гидрирование Нойори (восстановление бета-кетоэфира / Ru / BINAP) и восстановление CBS (BH 3, хиральный катализатор на основе пролина).