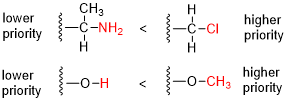 Пример приоритезации структуры в системе CIP. Приоритет назначается в соответствии с заменой элементов с более высокими атомными номерами, или другие присоединенные группы. Красным цветом обозначен заместитель, который определяет окончательный приоритет (изображение выше).
Пример приоритезации структуры в системе CIP. Приоритет назначается в соответствии с заменой элементов с более высокими атомными номерами, или другие присоединенные группы. Красным цветом обозначен заместитель, который определяет окончательный приоритет (изображение выше). Правила последовательности Кан-Ингольд-Прелог (CIP ), названный в честь органических c Hemists Роберт Сидни Кан, Кристофер Келк Ингольд и Владимир Прелог - альтернативно называемые правилами приоритета CIP, системой или условные обозначения - это стандартный процесс, используемый в органической химии для полного и однозначного определения стереоизомера молекулы. Целью системы CIP является присвоение дескриптора R или S каждому стереоцентру и дескриптора E или Z для каждой двойной связи, чтобы можно было указать конфигурацию всей молекулы. уникальным образом, включив дескрипторы в его систематическое имя. Молекула может содержать любое количество стереоцентров и любое количество двойных связей, и каждая обычно дает два возможных изомера. Молекула с целым числом n, описывающим количество ее стереогенных центров, обычно будет иметь 2 стереоизомера и 2 диастереомера, каждый из которых имеет связанную пару энантиомеров. Правила последовательности CIP способствуют точному наименованию каждого стереоизомера каждой органической и металлоорганической молекулы со всеми атомами лигантности менее 4 (но включая лигантность 6, этот термин относится к «количеству соседних атомов», связанных с центром).
Ключевая статья, устанавливающая правила последовательности CIP, была опубликована в 1966 году, и за ней последовали дальнейшие уточнения, прежде чем был включен в правила Международного союза теоретической и прикладной химии (IUPAC), официального органа, определяющего органическую номенклатуру, в 1974 году. С тех пор правила были пересмотрены, последний раз в 2013 г. в рамках книги ИЮПАК Номенклатура органической химии. Представленные ИЮПАК правила представляют собой официальный формальный стандарт для их использования, и в нем отмечается, что «метод был разработан для охвата всех соединений с лиганностью до 4... и... [расширен на случай] лигантности 6... [а также] для всех конфигураций и конформаций таких соединений ". Тем не менее, хотя документация ИЮПАК представляет собой подробное введение, она включает предупреждение о том, что «важно изучить исходные статьи, особенно статью 1966 года, прежде чем использовать правило последовательности для иных, чем довольно простых случаев».
В недавней статье приводятся доводы в пользу изменения некоторых правил (правила последовательности 1b и 2) для обращения к определенным молекулам, для которых правильные дескрипторы не были ясны. Однако остается другая проблема: в редких случаях два разных стереоизомера одной и той же молекулы могут иметь одинаковые дескрипторы CIP, поэтому система CIP не может однозначно назвать стереоизомер, и другие системы могут быть предпочтительнее.
Шаги для наименования молекул с использованием системы CIP часто представлены как:
Дескрипторы R / S и E / Z назначаются с использованием системы ранжирования приоритета групп прикреплены к каждому стереоцентру. Эта процедура, часто известная как правила последовательности, является сердцем системы CIP. Обзор в этом разделе опускает некоторые правила, которые необходимы только в редких случаях.
Если две группы отличаются только изотопами, то большая атомная масса используется для установки приоритета.
 В этом примере демонстрируется «правило разделения и дублирования» для двойных связей. Виниловая группа (C = C) или алкеновая часть имеет более высокий приоритет по сравнению с алкановой (C-C) частью.
В этом примере демонстрируется «правило разделения и дублирования» для двойных связей. Виниловая группа (C = C) или алкеновая часть имеет более высокий приоритет по сравнению с алкановой (C-C) частью. Если атом A связан двойной связью с атомом B, A рассматривается как одинарно связанный с двумя атомы: B и «призрачный атом», который является дубликатом B (имеет тот же атомный номер), но не связан ни с чем, кроме A. Когда B заменяется списком присоединенных атомов, сам A, но не его «призрак» ", исключается в соответствии с общим принципом недопущения возврата по облигации, который только что был соблюден. С тройной связью обращаются так же, за исключением того, что каждый из A и B связан с двумя призрачными атомами другого.
Если два заместителя на атоме являются геометрическими изомерами друг друга, Z-изомер имеет более высокий приоритет, чем E-изомер.
Чтобы обработать молекулу, содержащую один или несколько циклов, нужно сначала развернуть ее в дерево (называемое иерархический орграф ) путем обхода связей по всем возможным путям, начиная со стереоцентра. Когда обход встречает атом, через который уже прошел текущий путь, генерируется призрачный атом, чтобы дерево оставалось конечным. Один атом исходной молекулы может появляться во многих местах (некоторые как призраки, некоторые нет) в дереве.
 Два примера стереоцентров. Самый низкий заместитель (номер 4) показан только волнистой линией и предполагается, что он находится за остальной частью молекулы. Оба показанных центра являются S-изомерами.
Два примера стереоцентров. Самый низкий заместитель (номер 4) показан только волнистой линией и предполагается, что он находится за остальной частью молекулы. Оба показанных центра являются S-изомерами. После того, как заместителям в стереоцентре были назначены их приоритеты, молекула ориентируется в пространстве так, что указывается группа с самым низким приоритетом от наблюдателя. Если заместители пронумерованы от 1 (высший приоритет) до 4 (низший приоритет), то направление вращения кривой, проходящей через 1, 2 и 3, различает стереоизомеры. Центр с направлением вращения по часовой стрелке - это центр R (прямая мышца), а центр с направлением вращения против часовой стрелки - это центр S (зловещий). Имена образованы от латинского для «правого» и «левого» соответственно.
 Пример дескриптора a (s): (1R, 2s, 3S) -1,2,3- трихлорциклопентан
Пример дескриптора a (s): (1R, 2s, 3S) -1,2,3- трихлорциклопентан Практический метод определения того, является ли энантиомер R или S, заключается в использовании правила правой руки : молекулу оборачивают пальцами в направлении 1 → 2 → 3. Если большой палец указывает в направлении четвертого заместителя, энантиомер представляет собой R; в противном случае это S.
В редких случаях возможно, что два заместителя у атома отличаются только своей абсолютной конфигурацией (R или S). Если необходимо установить относительные приоритеты этих заместителей, R имеет приоритет над S. Когда это происходит, дескриптор стереоцентра представляет собой строчную букву (r или s) вместо обычно используемой прописной буквы.
Для алкенов и аналогичных молекул с двойными связями применяется тот же процесс определения приоритетов для заместителей. В этом случае имеет значение размещение двух заместителей с наивысшим приоритетом по отношению к двойной связи. Если оба высокоприоритетных заместителя находятся на одной стороне двойной связи, то есть в цис-конфигурации, тогда стереоизомеру присваивается Z (цусаммен). Если, напротив, они находятся в транс-конфигурации, тогда стереоизомеру присваивается E (entgegen). В этом случае идентифицирующие буквы являются производными от немецкого языка для слов «вместе» и «напротив» соответственно.
Ниже приведены примеры применения номенклатуры.
| Назначение R / S для нескольких соединений | |
|---|---|
 | Гипотетическая молекула бромхлорфториодметан, показанная в ( R) -конфигурация будет очень простым хиральным соединением. Приоритеты назначаются на основе атомного номера (Z): йод (Z = 53)>бром (Z = 35)>хлор (Z = 17)>фтор (Z = 9). Позволяя фтору (самый низкий приоритет) направлять в сторону от зрителя, вращение происходит по часовой стрелке, отсюда и назначение R. |
 | При присвоении L-серина наивысший приоритет отдается атому азота (Z = 7) в аминогруппе (NH 2). И гидроксиметильная группа (CH 2 OH), и группа карбоновой кислоты (COOH) имеют атомы углерода (Z = 6), но приоритет отдается последней поскольку атом углерода в группе COOH соединен со вторым кислородом (Z = 8), тогда как в группе CH 2 OH углерод соединен с водородом атом (Z = 1). Наименьший приоритет дается атому водорода, и поскольку этот атом направлен в сторону от наблюдателя, уменьшение приоритета против часовой стрелки над тремя оставшимися заместителями завершает присвоение S. |
 | Стереоцентр в (S) -карвоне связан с одним атомом водорода (не показан, приоритет 4) и тремя атомами углерода. Группа имеет приоритет 1 (только атомы углерода), а для двух оставшихся атомов углерода приоритет определяется с помощью атомов углерода, двух связей, удаленных из стереоцентра, одной части кето группы (O, O, C, приоритет 2) и одну часть алкена (C, C, H, приоритет 3). Результирующее вращение против часовой стрелки приводит к S. |
Если соединение имеет более одного стереоцентра, каждый центр обозначается буквой R или S. Например, эфедрин существует с обе конфигурации (1R, 2S) и (1S, 2R), известные как энантиомеры. Это соединение также существует в конфигурациях (1R, 2R) и (1S, 2S). Последние два стереоизомера представляют собой не эфедрин, а псевдоэфедрин. Все изомеры представляют собой 2-метиламино-1-фенил-1-пропанол в систематической номенклатуре. Псевдоэфедрин химически отличается от эфедрина только его трехмерной конфигурацией в пространстве, как указано в правилах Кана – Ингольда – Прелога. Два соединения, эфедрин и псевдоэфедрин, являются диастереомерами или стереоизомерами, которые не являются энантиомерами. У них разные названия, потому что как диастереомеры они имеют разные химические свойства.
В парах энантиомеров все дескрипторы противоположны: (R, R) и (S, S) или (R, S) и (S, R). Диастереомеры имеют один общий дескриптор: (R, S) и (R, R) или (S, R) и (S, S). Это верно для соединений с более чем двумя стереоцентрами; если хотя бы один дескриптор одинаков в обеих парах, соединения являются диастереомерами. Если все стереоцентры противоположны, они энантиомеры.
Относительная конфигурация двух стереоизомеров может быть обозначена дескрипторами R и S со звездочкой (*). (R *, R *) означает два центра, имеющих идентичную конфигурацию, (R, R) или (S, S); (R *, S *) означает два центра, имеющих противоположные конфигурации, (R, S) или (S, R). Для начала стереогенному центру с наименьшим номером (согласно систематической нумерации IUPAC) присваивается дескриптор R *.
Для обозначения двух аномеров используются относительные стереодескрипторы альфа (α) и бета (β). В α-аномере аномерный атом углерода и эталонный атом имеют противоположные конфигурации (R, S) или (S, R), тогда как в β-аномере они одинаковы (R, R) или (S, S).
 Ацетофенон и
Ацетофенон и Стереохимия также играет роль в назначении граней тригональным молекулам, таким как кетоны. нуклеофил в нуклеофильном присоединении может приближаться к карбонильной группе с двух противоположных сторон или граней. Когда ахиральный нуклеофил атакует ацетон, обе грани идентичны и есть только один продукт реакции. Когда нуклеофил атакует бутанон, лица не идентичны (энантиотопный ), и получается рацемический продукт. Когда нуклеофилом является хиральная молекула, образуются диастереоизомеры. Когда одна грань молекулы экранирована заместителями или геометрическими ограничениями по сравнению с другой гранью, эти грани называют диастереотопными. Те же правила, которые определяют стереохимию стереоцентра (R или S), также применяются при назначении грани молекулярной группы. Грани тогда называются Re-face и Si-face . В примере, показанном справа, соединение ацетофенон просматривается с Re-face. Добавление гидрида, как в процессе восстановления с этой стороны, будет формировать (S) -энантиомер, а атака с противоположной Si-грани даст (R) -энантиомер. Однако следует отметить, что добавление химической группы к прохиральному центру из Re-face не всегда приводит к (S) -стереоцентру, так как необходимо учитывать приоритет химической группы. То есть абсолютная стереохимия продукта определяется сама по себе, а не с учетом того, с какой стороны он подвергся атаке. В вышеупомянутом примере, если хлорид (Z = 17) был добавлен к прохиральному центру из Re-face, это привело бы к (R) -энантиомеру.