В химии, правило выбора (также известное как правило перехода) формально ограничивают возникновение определенных реакций, известных как запрещенных по спину реакций, из-за необходимого изменения между двумя различными квантовыми состояниями. Когда реагент находится в одном спиновом состоянии, а продукт существует в другом спиновом состоянии, соответствующая реакция будет иметь повышенную энергию активации по сравнению с аналогичной реакцией, в которой спиновые состояния реагента и продукта изоморфны. В результате этой повышенной энергии активации наблюдается снижение скорости реакции.
 Синглетные и триплетные комплексы кобальта. основное состояние TpCo (CO) имеет два неспаренных электрона..
Синглетные и триплетные комплексы кобальта. основное состояние TpCo (CO) имеет два неспаренных электрона..Синглетные и триплетные состояния также могут возникать внутри металлоорганических комплексов, таких как TpCo (CO) 2 и TpCo (CO) соответственно.
 Синглетные и триплетные молекулярные орбитали.
Синглетные и триплетные молекулярные орбитали. Когда реакция переводит металл из синглетного в триплетное состояние (или наоборот):
Сильная спин-орбитальная связь может удовлетворять второму условию. Параметр 1, однако, может привести к очень медленным реакциям из-за больших различий между поверхностями потенциальной энергии металлического комплекса, которые пересекаются только при высокой энергии, что приводит к значительному активационному барьеру.
Спин-запрещен. реакции формально относятся к категории электронно неадиабатических реакций. В общем, поверхности потенциальной энергии подразделяются на адиабатическую и диабатическую классификацию. Поверхности потенциальной энергии, которые являются адиабатическими, основываются на использовании полного электронного гамильтониана, который включает член спин-орбита. Те, которые являются диабатическими, аналогичным образом выводятся путем решения собственных значений уравнения уравнения Шредингера, но в этом случае один или несколько членов опускаются.
 Поверхности потенциальной энергии для запрещенных по спину реакций как диабатической, так и адиабатической разновидностей. Разница между двумя адиабатическими поверхностями составляет 2H 12, где H 12= <Ψ1|Hsoc |Ψ2>.
Поверхности потенциальной энергии для запрещенных по спину реакций как диабатической, так и адиабатической разновидностей. Разница между двумя адиабатическими поверхностями составляет 2H 12, где H 12= <Ψ1|Hsoc |Ψ2>.Один раз минимальная энергия точка пересечения достигнута и параметр 1, указанный выше, удовлетворяется, системе необходимо перепрыгивать с одной диабатической поверхности на другую, как указано выше в параметре 2. При заданной энергии (E ) коэффициент скорости [k (E) ] реакции, запрещенной по спину, можно рассчитать с использованием плотности колебательных состояний реагента [ρ (E) ] и эффективного интегрированного плотность состояний в стыке пересечения между двумя поверхностями [Ner(E) ].

где

Вероятность скачкообразного изменения (psh) рассчитывается по теории Ландау-Зинера, что дает

где

, в котором спин-орбитальное взаимодействие получено из диагонального матричного элемента гамильтониана между двумя электронными состояниями (H12), относительного наклона двух поверхностей в пересекающийся шов [F (Δ) ], приведенная масса системы за счет ее движения по координате прыжка (μ ) и кинетическая энергия системы, проходящей через точку пересечения (E ) используются.
Полезно отметить, что при E h< Ec(когда энергия ниже точки пересечения минимальной энергии) вероятность перескока между спиновыми состояниями равна нулю.
Один пример, показывающий эффект замедления реакции, запрещенной по спину, имеет место, когда Fe (CO) xнаходится под давлением CO . Переходы от x = 2,3,4 к x-3,4,5 демонстрируют замедление скорости, когда реагент находится в основном триплетном состоянии, но продукт находится в синглетном основном состоянии. штат. В случае Fe (CO) x, когда x = 2,3,4, железо существует в виде триплета в основном состоянии; когда x = 5, железо существует в виде синглета в основном состоянии. Кинетика указанной системы может быть представлена следующим образом:
 Энергетические диаграммы Fe (CO) n → Fe (CO) n + 1 На изображении выше показана энергия диаграммы переходов при добавлении CO и металлоорганической молекуле с Fe-центром. Первые три комплекса имеют S = 2, а последний - S = 0.
Энергетические диаграммы Fe (CO) n → Fe (CO) n + 1 На изображении выше показана энергия диаграммы переходов при добавлении CO и металлоорганической молекуле с Fe-центром. Первые три комплекса имеют S = 2, а последний - S = 0. ![{\displaystyle {\ce {Fe(CO)2->[{k_ {23}}] [CO] Fe (CO) 3 ->[{k_ {34 }}] [CO] Fe (CO) 4 ->[{k_ {45}}] [CO] Fe (CO) 5}}}]( https : //wikimedia.org/api/rest_v1/media/math/render/svg/5bba6aa1ab4092d76cdd505c9d0d7dcac1f3b13e )
где:
 ,
, и
и .
.Константы скорости a bove, в частности, не зависят от температуры, протестированы при 55 ° C, 21 ° C и 10 ° C, что указывает, по мнению авторов, что наблюдаемое 500-кратное снижение скорости происходит из-за запрещенной по спину природы последнего уравнения, а не из-за из-за кинетики добавления дополнительного лиганда.
Ассоциация лиганда и диссоциация от металлических центров включают фундаментальное изменение в координационной сфере этого металла. Это изменение в некоторых реакциях также требует изменения спинового состояния, которое может замедлить скорость ассоциации лигандов. Окислительное добавление и восстановительное устранение можно рассматривать аналогично ассоциации и диссоциации лиганда, соответственно. Математически скорость диссоциации лиганда может увеличиваться, когда реакция переходит от одного спинового состояния к другому, хотя следует отметить, что этот эффект часто невелик по сравнению с другими факторами, такими как стерильность вокруг металлического центра.
Вставка в связи CH, известная как активация CH, является неотъемлемым первым шагом в функционализации CH. Для некоторых комплексов металлов с идентичными лигандами активация CH происходит быстро, когда используется один металл, и медленно, когда используются другие металлы, часто переходные металлы первого ряда, из-за разрешенной по спину природы первого случая и запрещенной по спину природы второго. кейс. Разница в скоростях C-H-активации метана для CoCp (CO), RhCp (CO) и IrCp (CO) легко демонстрирует это свойство. CoCp (CO), исходный материал при активации CH, существует в триплетном спиновом состоянии, в то время как RhCp (CO) существует в синглетном состоянии с триплетное состояние всего 5,9 ккал / моль. IrCp (CO) уникален среди этих комплексов тем, что его исходное состояние по существу вырождено между триплетным и синглетным состояниями. Данный продукт введения CH, CpMH (CO) (CH 3), где M = Co, Rh, Ir, находится в синглетном состоянии, что означает, что активация CH с помощью CoCp ( CO) должен достичь точки пересечения с минимальной энергией для поверхностей потенциальной энергии реагента и продукта, что требует относительно высоких энергий для продолжения.

За счет использования фотолиз, скорость окислительного добавления в связи кремний - водород, как было показано, увеличивается, когда исходный материал возбуждается до правильного спинового состояния. CpRe (CO) 2и CpMn (CO) 2были подвергнуты фотолизу для изменения их спинового состояния с триплетного на синглетное и наоборот, соответственно, так что окислительная добавка к Et 3 Si-H может происходить с очень большой скоростью.
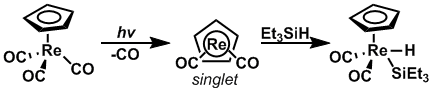
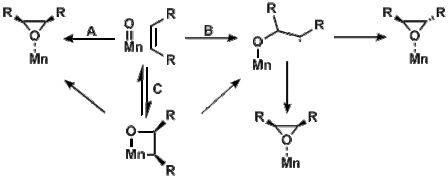 Реакции оксокомплексов марганца с алкенами. В зависимости от спинового состояния исходного материала, триплет или квинтет в данном случае, маршрут A, B, или C может быть пройден, давая потенциально разные продукты. Реакции также протекают по-разному для разных заместителей R, где один всегда представляет собой алкил, а второй - алкил в случае пути A, арил, алкенил или алкинил в случае маршрута B или алкил, арил, алкенил или алкинил для маршрута C . Для маршрутов B и C алкил R является внутренним для случая радикала.
Реакции оксокомплексов марганца с алкенами. В зависимости от спинового состояния исходного материала, триплет или квинтет в данном случае, маршрут A, B, или C может быть пройден, давая потенциально разные продукты. Реакции также протекают по-разному для разных заместителей R, где один всегда представляет собой алкил, а второй - алкил в случае пути A, арил, алкенил или алкинил в случае маршрута B или алкил, арил, алкенил или алкинил для маршрута C . Для маршрутов B и C алкил R является внутренним для случая радикала. Металл-оксо-частицы из-за их небольшой пространственной протяженности металла -центрированные d-орбитали, ведущие к слабой связи, часто имеют одинаковую энергию как для низкоспиновой (

