Мембранные везикулы оборот в эукариотических клетках животных включает в себя перемещение важных биохимических сигнальных молекул из синтеза-и-упаковочных мест в организме Гольджи к специфическому «освобождению» местам на внутренней стороне плазматической мембраны секреторной клетки, в виде Гольджи мембранно связанные везикулы микро-размера, называемые мембранными везикулами (МВ). В этом процессе «упакованные» клеточные продукты высвобождаются / секретируются за пределы клетки через ее плазматическую мембрану. Однако эта везикулярная мембрана сохраняется и повторно используется секреторными клетками. Это явление играет ключевую роль в синаптической нейротрансмиссии, эндокринной секреции слизистой секреции, зернистые продукты секреции по нейтрофилам и т.д. Ученые за это открытием были награждены Нобелевской премия за 2013 год В прокариотических грамотрицательных бактериальных клетках, мембранные везикулы Транспортировка осуществляется через связанные с бактериальной внешней мембраной наноразмерные везикулы, называемые везикулами бактериальной внешней мембраны (OMV). Однако в этом случае мембрана OMV также секретируется вместе с содержимым OMV за пределы секретно-активной бактерии. Это явление играет ключевую роль во взаимодействиях хозяин-патоген, эндотоксическом шоке у пациентов, инвазии и заражении животных / растений, межвидовой конкуренции бактерий, зондировании кворума, экзоцитозе и т. Д.
 Здесь образуется везикула, когда собираются грузы, рецепторы и белки оболочки. Затем пузырек распускается наружу и прорывается в цитоплазму. Везикула перемещается к своему целевому положению, затем стыкуется и сливается.
Здесь образуется везикула, когда собираются грузы, рецепторы и белки оболочки. Затем пузырек распускается наружу и прорывается в цитоплазму. Везикула перемещается к своему целевому положению, затем стыкуется и сливается. Как только везикулы образуются в эндоплазматическом ретикулуме и модифицируются в теле Гольджи, они попадают в самые разные места внутри клетки. Сначала пузырьки покидают тело Гольджи и попадают в цитоплазму в процессе, называемом почкованием. Затем везикулы перемещаются к месту назначения с помощью моторных белков. Как только везикула достигает места назначения, она соединяется с билипидным слоем в процессе, называемом слиянием, а затем высвобождает свое содержимое.
Рецепторы, встроенные в мембрану тела Гольджи, связывают определенный груз (например, дофамин) на просветной стороне везикулы. Эти рецепторы груза затем рекрутируют множество белков, включая другие рецепторы груза и белки оболочки, такие как клатрин, COPI и COPII. По мере того, как все больше и больше этих покрывающих белков объединяются, они заставляют везикулу отрастать наружу и в конечном итоге вырываются в цитоплазму. Белки оболочки затем попадают в цитоплазму для повторного использования и повторного использования.
Для перемещения между различными компартментами внутри клетки везикулы полагаются на моторные белки миозин, кинезин (прежде всего антероградный транспорт) и динеин (прежде всего ретроградный транспорт). Один конец моторных белков прикрепляется к везикуле, а другой конец - к микротрубочкам или микрофиламентам. Затем моторные белки перемещаются путем гидролиза АТФ, который продвигает везикулу к месту назначения.
Когда везикула приближается к своему предполагаемому местоположению, белки RAB в мембране везикулы взаимодействуют с белками стыковки в месте назначения. Эти стыковочные белки приближают везикулу для взаимодействия с комплексом SNARE, обнаруженным в мембране-мишени. Комплекс SNARE реагирует с синаптобревином, обнаруженным на мембране везикул. Это прижимает мембрану везикул к мембране целевого комплекса (или внешней мембране клетки) и заставляет две мембраны сливаться. В зависимости от того, сливается ли везикула с целевым комплексом или с внешней мембраной, содержимое везикулы затем высвобождается либо в целевой комплекс, либо за пределы клетки.
Все эти типы (1–4) способов транспортировки мембранных везикул, происходящие в эукариотических клетках, были объяснены схематично.
В отличие от эукариот, мембранный везикулярный перенос у прокариот является новой областью интерактивной биологии для внутривидовой (кворум-зондирование) и межвидовой передачи сигналов на интерфейсе хозяин-патоген, поскольку прокариоты лишены внутренней мембранной компартментализации их цитоплазмы. Дисперсию бактериальных мембранных везикул по поверхности клетки измеряли на живых Escherichia coli, комменсальных бактериях, распространенных в кишечнике человека. Лечение антибиотиками изменило динамику везикул, сродство везикул к мембране и поверхностные свойства клеточных мембран, в целом усиливая транспорт везикул по поверхности бактериальных мембран и предполагая, что их свойства движения могут быть признаком антибиотического стресса.
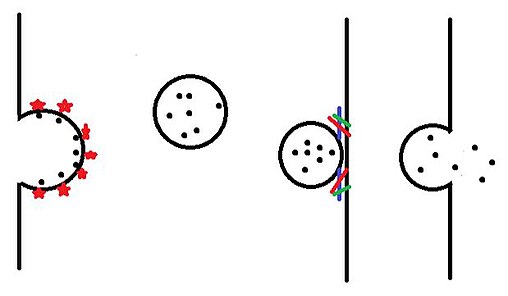
На протяжении более четырех десятилетий культуры грамотрицательных микробов выявляли наличие наноразмерных мембранных везикул. Роль мембранных везикул в патогенных процессах подозревалась с 1970-х годов, когда они наблюдались в зубном налете десны с помощью электронной микроскопии. Предполагалось, что эти везикулы способствуют адгезии бактерий к поверхности эпителиальных клеток хозяина. Затем была продемонстрирована их роль в инвазии клеток-хозяев животных in vivo. Было показано, что при межбактериальных взаимодействиях OMV, высвобождаемые микробами Pseudomonas aeruginosa, сливаются с внешней мембраной других грамотрицательных микробов, вызывая их бактериолиз; Эти OMV также могут лизировать грамположительные микробы. Роль OMV, в Helicobacter Pylori инфекции человека первичных антральных эпителиальных клеток, как модель, которая близко напоминает человеческий желудок, также была подтверждена VacA-содержащие OMV, также могут быть обнаружены в слизистой оболочки желудка человека, инфицированных H.pylori.. Было также показано, что OMV сальмонеллы играют непосредственную роль в инвазии эпителиальных клеток подвздошной кишки цыпленка in vivo в 1993 году (ссылка 4) и позже, в перехвате защитных макрофагов в суб-службу для репликации патогенов и последующего апоптоза инфицированных макрофагов при брюшном тифе. -подобная инфекция животных. Эти исследования привлекли внимание к OMV в переносе мембранных везикул и показали, что этот феномен участвует в различных процессах, таких как генетическая трансформация, определение кворума, арсенал конкуренции между микробами и т. Д., А также инвазия, инфекция, иммуномодуляция и т. Д. Животных-хозяев.. Уже был предложен механизм генерации OMV грамотрицательными микробами, вовлекающий расширение карманов периплазмы (называемых периплазматическими органеллами) из-за накопления секретов бактериальных клеток и их отщипывания в виде пузырьков, связанных с внешней мембраной (OMV) на линиях образование «мыльного пузыря» с помощью пузырьковой трубки и дальнейшее слияние или поглощение диффундирующих OMV клетками-хозяевами / клетками-мишенями (рис. 2).
 Рис.2 Механизм переноса мембранных пузырьков (AE), предложенный для высвобождения (стадии AC) пузырьков внешней мембраны, OMV из грамотрицательных бактерий по аналогии с образованием мыльного пузыря из сборки пузырьковой трубки (RC на стадии C) заклепки. комплексы, RC, и их транслокация (стадия D) к животному-хозяину / клетке-мишени, TC. Общий секреторный путь (GSP) секретирует белки через мембрану бактериальной клетки (CM), чтобы выпирать наружную мембрану (OM), обогащенную липополисахаридами (LPS), над слоем пептидогликана (PDG) в карманы раздутой периплазмы, называемые периплазматическими органеллами (PO), чтобы отщипнуть OMV, содержащие белки внешней мембраны (OMP), секреторные белки (SP) и шапероны (CH). OMV сигнализируют о том, что эпителиальные клетки-хозяева (EHC) взбудораживают (R), способствуя макропиноктозу грамотрицательных (G-) микробов (стадия E)
Рис.2 Механизм переноса мембранных пузырьков (AE), предложенный для высвобождения (стадии AC) пузырьков внешней мембраны, OMV из грамотрицательных бактерий по аналогии с образованием мыльного пузыря из сборки пузырьковой трубки (RC на стадии C) заклепки. комплексы, RC, и их транслокация (стадия D) к животному-хозяину / клетке-мишени, TC. Общий секреторный путь (GSP) секретирует белки через мембрану бактериальной клетки (CM), чтобы выпирать наружную мембрану (OM), обогащенную липополисахаридами (LPS), над слоем пептидогликана (PDG) в карманы раздутой периплазмы, называемые периплазматическими органеллами (PO), чтобы отщипнуть OMV, содержащие белки внешней мембраны (OMP), секреторные белки (SP) и шапероны (CH). OMV сигнализируют о том, что эпителиальные клетки-хозяева (EHC) взбудораживают (R), способствуя макропиноктозу грамотрицательных (G-) микробов (стадия E)  Фиг.3. Просвечивающая электронная микрофотография организма человека Salmonella, несущего периплазматические органеллы (p, линия, стрелка) на своей поверхности и высвобождающего бактериальные везикулы внешней мембраны (MV), эндоцитированные (изогнутая стрелка) клетками макрофага (M) в подвздошной кишке курицы in vivo.
Фиг.3. Просвечивающая электронная микрофотография организма человека Salmonella, несущего периплазматические органеллы (p, линия, стрелка) на своей поверхности и высвобождающего бактериальные везикулы внешней мембраны (MV), эндоцитированные (изогнутая стрелка) клетками макрофага (M) в подвздошной кишке курицы in vivo. В заключение, перенос мембранных везикул через OMV грамотрицательных организмов пересекает виды и царства, включая царство растений, в сфере передачи сигналов от клетки к клетке.