Клатрин - это белок, который играет главную роль в образовании покрытых оболочкой везикул. Клатрин был впервые выделен и назван Барбарой Пирс в 1976 году. Он образует форму трискелиона, состоящую из трех тяжелых цепей клатрина и трех легких цепей. Когда трискелии взаимодействуют, они образуют многогранную решетку, которая окружает везикулу, отсюда и название белка, которое происходит от латинского clathrum, что означает решетка. Белки оболочки, такие как клатрин, используются для создания маленьких пузырьков, чтобы транспортировать молекулы внутри клеток. эндоцитоз и экзоцитоз везикул позволяет клеткам общаться, передавать питательные вещества, импортировать сигнальные рецепторы, опосредовать иммунный ответ после отбора проб из внеклеточного мира и очищать клеточный мусор. оставленные воспалением тканей. Эндоцитарный путь может быть захвачен вирусами и другими патогенами, чтобы проникнуть в клетку во время инфекции.
| Легкая цепь клатрина a | |
|---|---|
| Идентификаторы | |
| Символ | CLTA |
| Ген NCBI | 1211 |
| HGNC | CLTA. HGNC: 2090. CLTA. |
| UniProt | P09496 |
| Прочие данные | |
| Locus | Chr. 9 q13 |
| Легкая цепь клатрина b | |
|---|---|
| Идентификаторы | |
| Символ | CLTB |
| Ген NCBI | 1212 |
| HGNC | 2091 |
| OMIM | 118970 |
| RefSeq | NM_001834 |
| UniProt | P09497 |
| Другие данные | |
| Locus | Chr. 5 q35 |
 Клатриновая клетка с единственным трискелионом, выделенным синим цветом. Карта CryoEM EMD_5119 была визуализирована в UCSF Chimera, и был выделен один трискелион клатрина.
Клатриновая клетка с единственным трискелионом, выделенным синим цветом. Карта CryoEM EMD_5119 была визуализирована в UCSF Chimera, и был выделен один трискелион клатрина. | Тяжелая цепь 1 клатрина | |
|---|---|
| Идентификаторы | |
| Символ | CLTC |
| Alt. символы | CHC, CHC17, CLTCL2 |
| NCBI ген | 1213 |
| HGNC | 2092 |
| OMIM | 118955 |
| RefSeq | NM_004859 |
| UniProt | Q00610 |
| Прочие данные | |
| Locus | Chr. 17 q23.1-qter |
 Каждая клетка состоит из 12 пятиугольников. Мини-покрытие (слева) имеет 4 шестиугольника и тетраэдрическую симметрию, как в усеченном трехугольном тетраэдре. Шестиугольный ствол (средний) имеет 8 шестиугольников и симметрию D6. Футбольный мяч (справа) имеет 20 шестиугольников и икосаэдрическую симметрию, как в усеченном икосаэдре.
Каждая клетка состоит из 12 пятиугольников. Мини-покрытие (слева) имеет 4 шестиугольника и тетраэдрическую симметрию, как в усеченном трехугольном тетраэдре. Шестиугольный ствол (средний) имеет 8 шестиугольников и симметрию D6. Футбольный мяч (справа) имеет 20 шестиугольников и икосаэдрическую симметрию, как в усеченном икосаэдре. 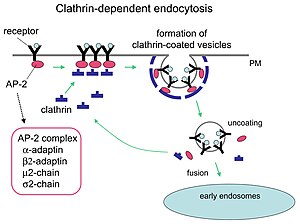 Механизм клатрин-опосредованного эндоцитоза.
Механизм клатрин-опосредованного эндоцитоза. | Тяжелая цепь клатрина 2 | |
|---|---|
| Идентификаторы | |
| Символ | CLTCL1 |
| Альт. символы | CLTCL |
| ген NCBI | 8218 |
| HGNC | 2093 |
| OMIM | 601273 |
| RefSeq | NM_001835 |
| UniProt | P53675 |
| Прочие данные | |
| Locus | Chr. 22 q11.21 |
| Повтор пропеллера клатрина | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Концевой домен клатрина Концевой домен клатрина | |||||||||
| Идентификаторы | |||||||||
| Символ | Clathrin_propel | ||||||||
| Pfam | PF01394 | ||||||||
| Pfam clan | CL0020 | ||||||||
| InterPro | IPR022365 | ||||||||
| SCOPe | 1bpo / SUPFAM | ||||||||
| |||||||||
| линкер тяжелой цепи клатрина | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 повтор тяжелой цепи клатрина повтор тяжелой цепи клатрина | |||||||||
| Идентификаторы | |||||||||
| Символ | клатрин-ссылка | ||||||||
| Pfam | PF09268 | ||||||||
| Pfam clan | CL0020 | ||||||||
| InterPro | IPR015348 | ||||||||
| SCOPe | 1b89 / SUPFAM | ||||||||
| |||||||||
Трискелион клатрина состоит из трех тяжелых цепей клатрина, взаимодействующих на своих С-концах, каждая тяжелая цепь ~ 190 кДа имеет ~ 25 кДа легкая цепь плотно с ней связана. Три тяжелые цепи обеспечивают структурный каркас решетки клатрина, а три легкие цепи, как полагают, регулируют образование и разборку решетки клатрина. Есть две формы легких цепей клатрина, обозначенные a и b. Основная тяжелая цепь клатрина, расположенная на хромосоме 17 у человека, обнаруживается во всех клетках. Второй ген тяжелой цепи клатрина на хромосоме 22 экспрессируется в мышцах.
Тяжелая цепь клатрина часто описывается как ножка с субдоменами, представляющими стопу (N-концевой домен), за которой следуют лодыжка, дистальная часть ноги, колено, проксимальная часть ноги и домены тримеризации. N-концевой домен состоит из структуры β-пропеллера с семью лопастями. Другие домены образуют суперспираль из коротких альфа-спиралей. Первоначально это было определено на основе структуры идентифицированного проксимального домена ноги, который состоит из меньшего структурного модуля, называемого повторяющимися мотивами тяжелой цепи клатрина. Легкие цепи связываются в основном с проксимальной частью тяжелой цепи с некоторым взаимодействием вблизи домена тримеризации. Β-пропеллер у «подножия» клатрина содержит множество сайтов связывания для взаимодействия с другими белками.
Когда трискелии собираются вместе в растворе, они могут взаимодействовать с достаточной гибкостью для образования 6-сторонних колец (шестиугольников ), которые образуют плоскую решетку, или 5-сторонних колец (пятиугольников ), которые необходимы для образования криволинейной решетки. Когда много трискелионов соединяются, они могут образовывать структуру, похожую на корзину. Показанная структура состоит из 36 трискелий, одна из которых показана синим цветом. Еще одна распространенная сборка - это усеченный икосаэдр. Чтобы заключить везикулу, в решетке должно присутствовать ровно 12 пятиугольников.
В клетке трискелион клатрина в цитоплазме связывается с адаптерным белком, который имеет связанную мембрану, соединяя одну из своих трех ножек с мембраной за раз. Клатрин не может напрямую связываться с мембраной или грузом и вместо этого использует для этого адаптерные белки. Этот трискелион будет связываться с другими прикрепленными к мембране трискелиями, образуя округлую решетку из шестиугольников и пятиугольников, напоминающую панели на футбольном мяче, которые вытягивают мембрану в бутон. Создавая различные комбинации 5-сторонних и 6-сторонних колец, везикулы разных размеров могут собираться. Самая маленькая клатриновая клетка, которую обычно изображают, называемая мини-пальто, имеет 12 пятиугольников и только два шестиугольника. Даже меньшие клетки с нулевыми шестиугольниками, вероятно, не образуются из нативного белка, потому что ножки трискелий слишком громоздки.
Клатрин выполняет критические роли в формировании округлых пузырьков в цитоплазме для внутриклеточного трафика. Покрытые клатрином везикулы (CCV) селективно сортируют груз на клеточной мембране, транс- сети Гольджи и эндосомном компартментах для множественных путей мембранного движения. После того, как везикула прорастает в цитоплазму, оболочка быстро разбирается, позволяя клатрину рециркулировать, а везикула транспортируется в различные места.
Адаптерные молекулы ответственны за самосборку и рекрутирование. Двумя примерами адаптерных белков являются AP180 и эпсин. AP180 используется для образования синаптических пузырьков. Он привлекает клатрин к мембранам, а также способствует его полимеризации. Эпсин также привлекает клатрин к мембранам и способствует его полимеризации и может помочь деформировать мембрану, и, таким образом, везикулы, покрытые клатрином, могут образоваться. В клетке трискелион, плавающий в цитоплазме, связывается с адаптерным белком, соединяя одну из своих ножек с мембраной за раз. Скелион будет связываться с другими, прикрепленными к мембране, образуя многогранную решетку, скелион, которая вытягивает мембрану в бутон. Скелион не связывается напрямую с мембраной, но связывается с адапторными белками, которые распознают молекулы на поверхности мембраны.
Клатрин выполняет еще одну функцию, помимо покрытия органелл. В неделящихся клетках образование везикул, покрытых клатрином, происходит непрерывно. Формирование везикул, покрытых клатрином, прекращается в клетках, подвергающихся митозу. Во время митоза клатрин связывается с аппаратом веретена в комплексе с двумя другими белками: TACC3 и ch-TOG / CKAP5. Клатрин способствует сращиванию хромосом, стабилизируя кинетохор волокон митотического веретена. Аминоконцевой домен тяжелой цепи клатрина и домен TACC TACC3 заставляют поверхность связывания микротрубочек для TACC3 / ch-TOG / клатрина связываться с митотическим веретеном. Для стабилизации волокон кинетохор требуется тримерная структура клатрина для сшивания микротрубочек.
Клатрин-опосредованный эндоцитоз (CME) регулирует многие клеточные физиологические процессы, такие как интернализация факторов роста и рецепторов, проникновение патогенов и синаптическая передача. Считается, что захватчики клеток используют питательные пути, чтобы получить доступ к механизмам репликации клетки. Определенные сигнальные молекулы открывают путь питательных веществ. Два химических соединения, называемые Pitstop 1 и Pitstop 2, селективные ингибиторы клатрина, могут препятствовать патогенной активности и, таким образом, защищать клетки от вторжения. Эти два соединения избирательно блокируют ассоциацию эндоцитарного лиганда с концевым доменом клатрина in vitro. Однако специфичность этих соединений для блокирования клатрин-опосредованного эндоцитоза была поставлена под сомнение.