Созревание in vitro (IVM ) - это метод разрешения содержимого фолликулы яичников и ооциты внутри зрелых in vitro. Он может быть предложен женщинам с проблемами бесплодия в сочетании с ЭКО, предлагая женщинам беременность без стимуляции яичников.
 Развитие фолликулов
Развитие фолликулов В 1935 году Pincus Enzmann провели первый эксперимент на незрелом ооците кролика, продемонстрировав спонтанное созревание и оплодотворение in vitro. Они показали, что созревание происходит изолированно от нормальной фолликулярной среды. В 1965 году Эдвардс продолжил исследования IVM на мышах, овцах, коровах, свиньях, макаках-резусах и людях. К 1991 году первая беременность была зарегистрирована с использованием IVM с последующим IVF, а в 1994 году были зарегистрированы первые роды с использованием ооцитов IVM от пациенток с синдромом поликистозных яичников, что подчеркивало, что ооциты пациенток с СПКЯ способны к созреванию.
Оогенез происходит во время жизни плода, при котором первичные зародышевые клетки подвергаются митозу за несколько недель до рождения, образуя оогонии. Затем они начинают мейоз с образованием ооцита в примордиальном фолликуле. Этот фолликул состоит из ооцита, окруженного уплощенными клетками прегранулезы. Младенцы рождаются с 1-2 миллионами примордиальных фолликулов, а к половому созреванию имеют около 300 тысяч. Из этих примордиальных фолликулов высвобождается только около 400 зрелых ооцитов, которые потенциально могут быть оплодотворены, а остальные подвергаются атрезии.
«Созревание» ооцита - это процесс, посредством которого «ооцит приобретает способность оплодотворяться. и претерпевают эмбриогенез ».
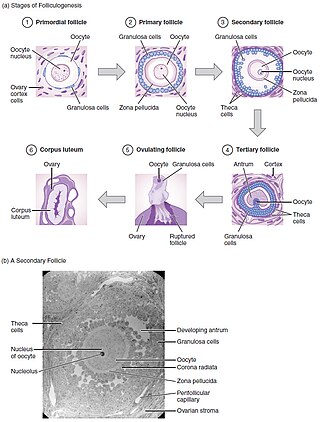
Фолликулогенез - это механизм созревания фолликулов яичников. Это может занять много месяцев in vivo и включает рост и дифференцировку примордиального фолликула.
Изначальные фолликулы, содержащие первичный ооцит, задержанный на профазе мейоза I, развиваются в первичный фолликул, содержащий клетки кубовидной гранулезы. Вторичный фолликул формируется из нескольких слоев клеток гранулезы, а также из слоя теки. Наконец, перед овуляцией образуется третичный фолликул, содержащий антральный отдел, заполненный фолликулярной жидкостью. Из этих небольших антральных фолликулов 1 станет доминирующим и овулирующим (у моновуляционных видов). Во время овуляции первичный ооцит возобновляет мейоз в ответ на сигналы, останавливаясь в метафазе мейоза II, готового к оплодотворению. Доминантный фолликул содержит зрелый ооцит. Развитие фолликулов находится под контролем гонадотропинов, ЛГ и ФСГ. Они используют цАМФ в качестве вторичного внутриклеточного посредника, при этом факторы роста и цитокины также влияют на их развитие in vivo.
Благодаря созреванию in vitro фолликулогенез и последние части оогенеза имитируются за пределами яичников, пытаясь воссоздать условия для этих процессов.
Если фолликул достиг ранней третичной или антральной стадии, может быть проведена IVM.
Во-первых, ооциты необходимо получить от субъекта. Время этого зависит от стадии цикла, в которой находится субъект, который обычно контролируется с помощью ультрасонографии. Если без использования прайминга, ооциты получают, когда самые большие фолликулы имеют размер около 10 мм.
У людей это можно сделать с помощью аспирационной иглы, используя ультразвук для обеспечения точности. В зависимости от того, собираете ли вы зрелые или незрелые фолликулы, протокол немного отличается. В обеих процедурах давление аспирации снижается, но в разной степени. Кроме того, более важно, чтобы аспират фильтровался при извлечении незрелых фолликулов, поскольку фолликулы намного меньше и их труднее увидеть в извлеченной жидкости.
Прайминг - это процесс, с помощью которого ооциты заполняются фолликулостимулирующий гормон (ФСГ) или хорионический гонадотропин человека (ХГЧ) перед извлечением. ХГЧ важен для женщин с синдромом поликистозных яичников (СПКЯ). Это приводит к расширению или диспергированию структуры кумулюса оофор вокруг яйцеклетки, что облегчает его идентификацию в фолликулярной жидкости. Это приводит к улучшенному созреванию и качеству ооцитов. Однако доказательства клинического эффекта прайминга ХГЧ все еще отсутствуют. Когда впервые была введена IVM, число успешных беременностей было низким, что привело к использованию прайминга яичников.
Этот метод также используется у овец, свиней и других животных. См. У животных.
Ооциты классифицируются в зависимости от их состояния, например количества кумулюсных клеток. Лучшие ооциты отбираются для созревания в надежде затем быть имплантированными с использованием методов оплодотворения in vitro.
Затем ооциты культивируют в среде, содержащей питательные вещества, важные для выживания ооцитов, такие как гонадотропины, факторы роста и стероиды. Они варьируются в зависимости от клиники и исследовательских лабораторий. Маклафлин и др. провели биопсию ткани яичников человека и достигли 10% скорости созревания однослойных фолликулов в метафазу II с помощью многоступенчатой системы культивирования:
Когда ооциты достаточно созреют, их можно оплодотворять in vitro, известное как оплодотворение in vitro (ЭКО). Такие методы, как интрацитоплазматическая инъекция сперматозоидов (ИКСИ), также могут быть использованы для повышения шансов на успешное оплодотворение, которое следует проводить как минимум через один час (а оптимально через два-четыре часа) после первого полярное тело экструзия. Из созревших ооцитов in vitro процент успешных оплодотворенных с помощью ИКСИ ооцитов составляет 60-80%, по сравнению с ЭКО с показателем успеха 25-40%.
Несколько живорождений уже родились с помощью небольших ранние третичные фолликулы, позволив им созреть in vitro и впоследствии оплодотворив. Однако для фолликулов, которые еще не достигли ранней третичной стадии, IVM все еще находится в стадии разработки. В ооците и остальных клетках фолликула происходит множество клеточных изменений, что делает его очень чувствительным. Тем не менее, можно позволить примордиальному фолликулу созреть до вторичного фолликула вне тела, вырастив его в срезе ткани яичника. Последующее созревание от вторичной до ранней третичной стадии может поддерживаться в пробирках. Было высказано предположение, что фотооблучение клеток гранулезы и ооцитов может облегчить внутривенно-кишечную опухоль.
Созревание in vitro - это вспомогательный репродуктивный метод (ART ) обычно используется у пациентов с проблемами фертильности, включая синдром поликистозных яичников (СПКЯ), высокое количество антральных фолликулов и гиперчувствительность яичников. Однако в последнее время IVM также стала широко применяться в таких областях, как сохранение фертильности у онкологических больных, прошедших курс лечения гонадотоксической терапией. Было зарегистрировано более 1000 живорождений от матерей с использованием ИВМ.
СПКЯ - распространенное заболевание, включающее дисфункцию эндокринной системы, связанную с женской репродуктивной функцией. СПКЯ включает несоответствия в эндокринной оси гипофиза-гипофиза-гонад, что может привести к гормональной дисфункции, избытку андрогенов (например, тестостерона) и частым ановуляторным менструальным циклам. Таким образом, женщинам, страдающим СПКЯ, часто требуется помощь для зачатия. У этих пациентов ИВМ может использоваться для созревания ооцитов и содействия зачатию.
Использование созревания in vitro при вспомогательной репродукции имеет преимущества перед стандартными процедурами ВРТ. В типичной практике ЭКО выполняется контролируемая гиперстимуляция яичников, при которой пациенту вводятся супрафизиологические уровни гонадотропинов для гиперстимуляции антральных фолликулов и, следовательно, индуцируют созревание ооцитов до метафазы II со скоростью, превышающей нормальные физиологические возможности. Эта практика может быть невыгодной по нескольким причинам: она очень дорогостоящая, может усложняться и также может предрасполагать к нескольким нежелательным побочным эффектам, таким как синдром гиперстимуляции яичников (СГЯ). Гиперстимуляция яичников может вызвать тяжелый СГЯ примерно в 2% случаев. СГЯ может иметь серьезные последствия, включая проблемы с дыханием, почечную недостаточность и даже инсульт. Пациенты с СПКЯ и молодые женщины подвергаются повышенному риску СГЯ. У этих женщин может быть даже более выгодным использовать IVM, чем обычное лечение IVF.
При IVM незрелые ооциты удаляются из антрального фолликула женщины, а затем созревают in vitro в культуре, богатой гонадотропины. Таким образом, это исключает (или значительно снижает) потребность в стимуляции гонадотропинами.
ИВМ не является полностью усовершенствованной техникой. Показатели беременности при ЭКО ниже, чем при стандартном ЭКО. Также требуется исследование, чтобы выяснить, есть ли у детей, рожденных от матерей, перенесших IVM, какие-либо проблемы со здоровьем (например, проблемы с развитием) в более позднем возрасте.
Женщины с личным или семейным анамнезом o эстрогена ассоциированный тромб или тяжелое сердечно-сосудистое заболевание также могут получить пользу от ИВМ. Это связано с тем, что обычное ЭКО с его гиперстимуляцией яичников может стимулировать массовый синтез эстрогена за счет стимуляции гранулезными клетками выработки эстрогена.
яичников. криоконсервация тканей может использоваться как метод сохранения фертильности, например, перед прохождением химиотерапии, которая может вызвать женское бесплодие, или в качестве будущего ресурса в если ооциты перестанут функционировать к преклонному возрасту матери. Таким образом, криоконсервация ткани яичника является альтернативой криоконсервации ооцитов, которая требует предшествующей контролируемой гиперстимуляции яичников. Созревание in vitro позволяет использовать ооциты из ткани яичника непосредственно для экстракорпорального оплодотворения в качестве альтернативы хирургическому повторному введению ткани в организм.
IVM также может быть важным фактором для пациентов женского пола с диагнозом синдром пустого фолликула (EFS ). В EFS ооциты не извлекаются из зрелых фолликулов яичников, несмотря на применение супрафизиологических уровней гонадотропинов. Женщине может быть поставлен диагноз EFS после того, как она перенесла несколько раундов ЭКО с полным (или почти полным) отказом в каждом раунде.
Rescue IVM - вариант классического созревания in vitro это включает в себя попытку созреть незрелые ооциты, которые были удалены у пациентки после гиперстимуляции яичников в стандартной практике ЭКО. Следовательно, позволяя большему количеству ооцитов созреть до стадии развития, на которой они могут быть жизнеспособными. Тем не менее, спасение IVM было рассмотрено спорным полем: Если ооциты не созрели в естественных условиях - несмотря на воздействие на значительные уровни гонадотропинов - это может свидетельствовать о dysmaturity и ограниченного потенциал онтогенетический
IVM также использовался у домашних животных, включая мышей, кошек, собак, свиней, овец, лошадей и крупный рогатый скот, а также у диких видов, таких как буйволы, бизоны, рыбы, львы, тигры и леопарды. Способность восстанавливать ооциты животных, изначально предназначенных для атрезии фолликулов яичников, может быть использована исследователями, защитниками природы и сельскохозяйственной промышленностью в академических целях или для улучшения систем разведения.
В исследованиях IVM может проводиться на животных, чтобы понять возможности развития ооцитов при определенных условиях или понять специфическую репродуктивную биологию в течение этого периода развития. IVM у других видов также проводится, поскольку некоторые животные используются в качестве моделей для изучения репродуктивной биологии человека. Это исследование часто проводится с целью улучшения показателей успешности систем in vitro и / или повышения фертильности in vivo.
Его также можно использовать для последующих биотехнологических приложений, таких как создание трансгенных животных с использованием инновационных методов редактирования генов, таких как CRISPR / Cas9, TALEN и ZFN для биомедицинских исследований. Пример включает генно-инженерных свиней с выключенными генами CD163 и CD1D . Одним из способов создания этих свиней было введение системы CRISPR / Cas9 в оплодотворенные ооциты, созревшие in vitro.
В сельском хозяйстве ИВМ обычно проводят перед ЭКО или искусственным оплодотворением как средство сохранения желаемых свойств определенных животных в стаде и противодействия снижению продуктивности в результате сезонного разведения. У таких видов домашнего скота, как крупный рогатый скот, трансвагинальное извлечение ооцитов из яичников живых самок животных может быть повторно выполнено до получения эмбрионов in vitro.
У не одомашненных животных IVM также может использоваться для сохранения исчезающих видов при сохранении генетического разнообразия. Однако из-за ограниченных ресурсов и видоспецифического характера вспомогательных репродуктивных технологий такие методы, как IVM, по-прежнему редко применяются для непомашенных животных.
В эксперименте Segers I et al. (2015), общая скорость созревания после ИВМ ооцитов, полученных из образцов после овариэктомии в лаборатории, составила 36%. Скорость созревания коррелировала с возрастом пациента и продолжительностью IVM. У 8 пар с криоконсервацией эмбриона коэффициент оплодотворения составил 65%. По крайней мере, один эмбрион хорошего качества на третий день был криоконсервирован у 7/8 пар. Этот эксперимент показывает, что IVM ооцитов, полученных ex vivo во время обработки коры яичников перед криоконсервацией, является многообещающим решением для пациентов с риском потери фертильности.
Успех получения эмбрионов in vitro зависит от использования эффективная методика извлечения ооцитов и наилучшие результаты были получены при лапароскопической аспирации.
Акушерские и перинатальные исходы родов из циклов IVM аналогичны таковым при ICSI лечения. Однако ИВМ предполагает использование инвазивных методик, это может навредить матери. Кроме того, эмбриологический исход IVM не установлен. Для более полной оценки состояния здоровья детей с IVM потребуются более масштабные проспективные исследования. Возможности криоконсервированных ооцитов IVM от онкологических больных остаются неизвестными. Оптимальное количество ооцитов IVM, замороженных в кандидатах на сохранение фертильности (FP), неизвестно. Ооциты FP бесплодных женщин с СПКЯ имеют пониженную компетентность по сравнению с ооцитами, полученными после стимуляции яичников. Стратегию FP по криоконсервации ооцитов после IVM следует рассматривать только в том случае, если стимуляция яичников невозможна.
У женщин с нормальным овуляторным состоянием вероятность успеха IVM ниже, чем у традиционных режимов стимуляции яичников с более низкой степенью имплантации и частоты наступления беременности. IVM не оптимален и зависит от нескольких факторов. Тем не менее, IVM - это более мягкий подход к лечению вспомогательной репродукции и альтернативная процедура для определенных условий. Точный отбор пациентов может улучшить клинический результат IVM.
IVM криоконсервированных ооцитов может помочь в срочном сохранении фертильности у онкологических больных. Однако данных об этом исходе недостаточно. Улучшение условий культивирования может увеличить скорость созревания и потенциал ооцитов IVM.
Кроме того, в ооцитах мышей добавление I-карнитина (LC) во время витрификации зародышевых пузырьков (GV) и их последующая IVM улучшила созревание ядра, а также сборку мейотического веретена и митохондриальное распределение в MII ооцитах. Однако на сегодняшний день нет данных, подтверждающих это преимущество в развитии плода и рождении здорового потомства после переноса эмбрионов суррогатным самкам. Однако этот протокол потенциально может улучшить качество витрифицированных человеческих ооцитов и эмбрионов во время IVM. В исследовании Wang X et al. (2014), гонадотропины влияют на созревание, оплодотворение и развитие ооцитов in vitro. Чувствительность ооцитов крупного рогатого скота к гонадотропинам in vitro зависит от относительных концентраций (ФСГ / ЛГ) для оптимальной компетентности развития ооцитов. Оптимальные концентрации ФСГ / ЛГ могут улучшить протоколы терапевтической клинической стимуляции и показатели успешности ЭКО.