Йодирование гидразона - это органическая реакция, в которой гидразон превращается в винилиодид посредством реакции йода и ненуклеофильного основания, такого как DBU. Впервые опубликованная Дереком Бартоном в 1962 году, эту реакцию иногда называют реакцией Бартона (хотя существует множество различных реакций Бартона) или, более описательно, процедурой винилиодирования Бартона.
Реакция имеет более ранние корни с открытием 1911 года Виландом и Розеу, что реакция гидразонов с одним йодом (без основания) приводит к димеру азина (структура 2 на схеме 1).
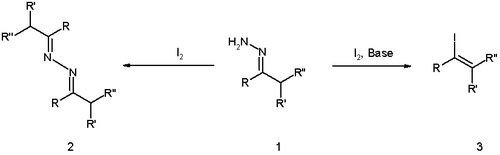
В исходной публикации Barton реакция была оптимизирована с помощью сильного гуанидинового основания, обратного добавления гидразона к раствору йода и исключения воды.

При замене йода в качестве электрофила ароматическими селенилбромидами получаются соответствующие винилселениды :

Механизм реакции, предложенный в оригинальной публикации Бартона, описан следующим образом:

Гидразон окисляется йодом до промежуточного диазо. На следующем этапе йод вступает в реакцию как электрофил; замещение азота затем генерирует ион йодокарбония. Когда место реакции не затруднено стерически, второй йодид может рекомбинировать с образованием геминального ди-йодида; в противном случае реакция элиминирования приводит к винилиодиду. Когда присутствует вода, продукт реакции может превратиться в кетон.
Эта реакция связана с реакцией Шапиро.
Примером этой процедуры является реакция 2,2,6-триметилциклогексанона с гидразоном путем взаимодействия с гидразином и триэтиламином в этаноле с обратным холодильником с последующей реакцией гидразона с йодом в присутствии 2-трет-бутил-1,1, 3,3-тетраметилгуанидин (дешевле DBU) в диэтиловом эфире при комнатной температуре. Другой пример можно найти в полном синтезе таксола Данишефского.
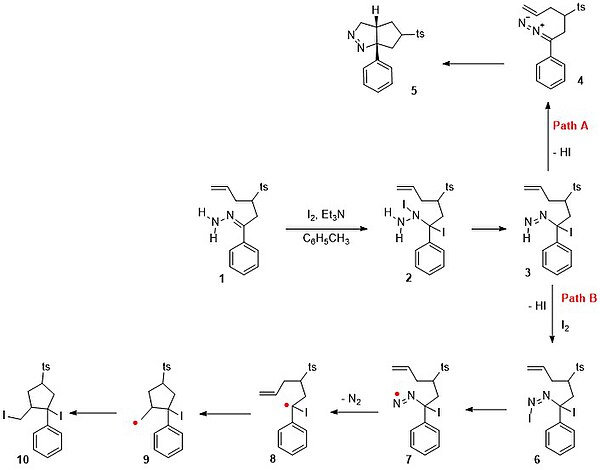
В одном исследовании пытались уловить любой реакционноспособный промежуточный продукт этой реакции с помощью внутреннего алкена. Когда гидразон 1 на схеме 5 взаимодействует с йодом и триэтиламином в толуоле, ожидаемым продуктом реакции не является дииодид 10 по пути B в свободнорадикальном механизме. Последовательность реакций, начиная с 1: реакция присоединения галогена к промежуточному дииодиду 2 с последующей реакцией элиминирования с потерей йодоводорода до 3. На пути B другой эквивалент йода реагирует на двойную азо-связь с последующей потерей HI и образованием 6. Связь азота и йода слабая, и при гомолизе образуется свободный радикал азота 7. Потеря азота приводит к образованию радикальных частиц 8. Положение радикала переносится на алкен в 9, который позже рекомбинирует с йодидом в 10. Обратите внимание, что в отсутствие алкена 8 принял бы иодидный радикал, и геминальный дииодид затем теряет HI с образованием винилиодида. Фактический процесс происходит это путь А с устранением из HI в диазо соединениях 4 с последующих диазоалканом 1,3-диполярным циклоприсоединением к пиразолину 5 с выходом 85%.