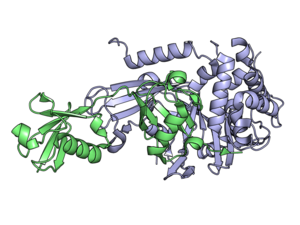
 USP21 (синий) ковалентно связан с линейным диубиквитиновый альдегид (зеленый). С-конец убиквитина выступает через активный сайт USP21 (внизу справа).
USP21 (синий) ковалентно связан с линейным диубиквитиновый альдегид (зеленый). С-конец убиквитина выступает через активный сайт USP21 (внизу справа). Деубиквитинирующие ферменты (DUB), также известные как деубиквитинирующие пептидазы, деубиквитинирующие изопептидазы, деубиквитиназы, протеазы убиквитиназы, убиквитин гидролазы, убиквитин изопептидазы, представляют собой большую группу протеаз, которые отщепляют убиквитин из белков. Убиквитин присоединяется к белкам, чтобы регулировать деградацию белков через протеасому и лизосому ; координировать клеточную локализацию белков; активировать и инактивировать белки; и модулировать белок-белковые взаимодействия. DUB могут обратить эти эффекты, разрывая пептидную или изопептидную связь между убиквитином и его белком-субстратом. У человека имеется около 100 генов DUB, которые можно разделить на два основных класса: цистеиновые протеазы и металлопротеазы. Цистеиновые протеазы включают убиквитин-специфические протеазы (USP), убиквитин-С-концевые гидролазы (UCH), протеазы домена Мачадо-Жозефина (MJD) и протеазы опухолей яичников (OTU). Группа металлопротеаз содержит только протеазы N-концевого + (MPN +) (JAMM) домена Jab1 / Mov34 / Mpr1 Pad1.
У людей их 102 предполагаемые гены DUB, которые можно разделить на два основных класса: цистеиновые протеазы и металлопротеазы, состоящие из 58 убиквитин-специфических протеаз (USP), 4 убиквитин-С-концевых гидролаз (UCHs), 5 протеаз домена Machado-Josephin (MJD), 14 протеаз опухолей яичников (OTU) и 14 генов, содержащих N-концевой + (MPN +) (JAMM) домен Pad1 Jab1 / Mov34 / Mpr1 Pad1. Предполагается, что 11 из этих белков будут нефункциональными, оставив 79 функциональных ферментов. В дрожжах USP известны как убиквитин-специфические процессирующие протеазы (UBP).
Существует шесть основных суперсемейств DUB цистеиновых протеаз:
| UCH | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 USP2 i n комплекс с убиквитином. USP2 i n комплекс с убиквитином. | |||||||||
| Идентификаторы | |||||||||
| Символ | UCH | ||||||||
| Pfam | PF00443 | ||||||||
| Pfam clan | CL0125 | ||||||||
| InterPro | IPR001394 | ||||||||
| PROSITE | PDOC00750 | ||||||||
| MEROPS | C19 | ||||||||
| SCOPe | 1nb8 / SUPFAM | ||||||||
| |||||||||
Существует также малоизвестная предполагаемая группа DUB, называемая пермутированными папаиновыми складчатыми пептидазами суперсемейства вирусов дцДНК и эукариот (PPPDE), которые, если показано, что они DUBs, будут седьмыми в классе цистеиновых протеаз.
Белки суперсемейства N-терминальный + (MPN +) (JAMM) домен Jab1 / Mov34 / Mpr1 Pad1 (JAMM) связывают цинк и, следовательно, являются металлопротеазами.
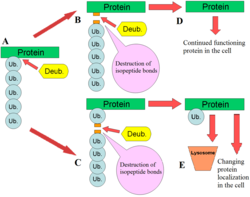 Схематическое изображение Функция DUB
Схематическое изображение Функция DUB DUB играют несколько ролей в пути убиквитина. Одной из наиболее охарактеризованных функций DUB является удаление цепей моноубиквитина и полиубиквитина из белков. Эти модификации представляют собой посттрансляционную модификацию (добавление к белку после того, как он был произведен), когда отдельные белки убиквитина или цепи убиквитина добавляются к лизинам белка-субстрата. Эти модификации убиквитина добавляются к белкам с помощью механизма убиквитинирования; убиквитин-активирующие ферменты (E1s), убиквитин-конъюгированные ферменты (E2s) и убиквитинлигазы (E3s). Конечным результатом является связывание убиквитина с остатками лизина посредством изопептидной связи. Эти модификации влияют на белки разными способами: они регулируют деградацию белков через протеасому и лизосому ; координировать клеточную локализацию белков; активировать и инактивировать белки; и модулировать белок-белковые взаимодействия. DUB играют антагонистическую роль в этой оси, удаляя эти модификации, тем самым изменяя судьбу белков. Кроме того, менее понятной ролью DUB является расщепление убиквитин-подобных белков, таких как SUMO и NEDD8. Некоторые DUB могут иметь способность расщеплять изопептидные связи между этими белками и белками-субстратами.
Они активируют убиквитин за счет протеолиза (разрушения) неактивных экспрессированных форм убиквитина. У млекопитающих убиквитин кодируется 4 разными генами: UBA52, RPS27A, UBB и UBC. Аналогичный набор генов обнаружен у других эукариот, например, у дрожжей. Гены UBA52 и RPS27A продуцируют убиквитин, который слит с рибосомными белками, а гены UBB и UBC продуцируют полиубиквитин (цепь убиквитина, соединенная их C- и N-концами ). DUBs отщепляют убиквитин от этих белков, производя единичные активные единицы убиквитина.
DUBs также расщепляют отдельные белки убиквитина, которые могли иметь свои C-концевые хвосты, случайно связанные с мелкими клетками нуклеофилы. Эти убиквитин- амиды и убиквитин- тиоэфиры могут образовываться во время стандартных реакций убиквитинирования посредством каскада E1-E2-E3. Глутатион и полиамины представляют собой два нуклеофила, которые могут атаковать тиолэфирную связь между убиквитином и этими ферментами. С-концевая гидролаза убиквитина является примером DUB, который гидролизует эти связи с широкой специфичностью.
Свободные цепи полиубиквитина расщепляются DUB с образованием моноубиквитина. Цепи могут продуцироваться механизмом E1-E2-E3 в клетке, свободной от любого белка-субстрата. Другой источник свободного полиубиквитина - продукт расщепления убиквитин-субстрат. Если DUB расщепляют основание полиубиквитиновой цепи, которая присоединена к белку, вся цепь станет свободной и ее нужно будет повторно использовать с помощью DUB.
 Каталитический домен USP7. Каталитические домены USP можно представить в виде пальцев ладони и большого пальца руки. Убиквитин помещается в руку, его С-конец проходит между большим пальцем и ладонью.
Каталитический домен USP7. Каталитические домены USP можно представить в виде пальцев ладони и большого пальца руки. Убиквитин помещается в руку, его С-конец проходит между большим пальцем и ладонью. DUB часто содержат каталитический домен, окруженный одним или несколькими дополнительными доменами, некоторые из которых способствовать распознаванию цели. Эти дополнительные домены включают домен, присутствующий в домене убиквитин-специфических протеаз (DUSP); убиквитиноподобный (UBL) домен; домен гомологии меприна и TRAF (MATH); домен убиквитин-специфической протеазы цинкового пальца (ZnF-UBP); миелоидный, нервный и DEAF1 (ZnF-MYND) домен; убиквитин-связанный (UBA) домен; CHORD-SGT1 (CS) домен; домен взаимодействия и доставки микротрубочек (MIT); роденазоподобный домен; Домен TBC / RABGAP; и домен B-бокса.
Каталитический домен DUB - это то, что классифицирует их в определенные группы; USP, OTU, MJD, UCH и MPN + / JAMM. Первые 4 группы представляют собой цистеиновые протеазы, тогда как последние представляют собой цинк металлопротеиназы. DUB цистеиновой протеазы подобны папаину и, следовательно, имеют аналогичный механизм действия. Они используют каталитические диады или триады (две или три аминокислоты ), чтобы катализировать гидролиз амидных связей между убиквитином и субстрат. Остатки активного центра, которые вносят вклад в каталитическую активность DUB цистеиновых протеаз, представляют собой цистеин (диада / триада), гистидин (диада / триада) и аспартат или аспарагин (только триада). Гистидин поляризуется аспартатом или аспарагином в каталитических триадах или другими способами в диадах. Этот поляризованный остаток снижает pKa цистеина, позволяя ему выполнять нуклеофильную атаку на изопептидную связь между убиквитином С-концом и субстратом <178.>лизин. Металлопротеазы координируют ионы цинка с остатками гистидина, аспартата и серина, которые активируют молекулы воды и позволяют им атаковать изопептидную связь.
Убиквитин-подобные (UBL) домены имеют структуру (складку), аналогичную убиквитину, за исключением того, что в них отсутствуют концевые остатки глицина. Предполагается, что 18 USP будут иметь домены UBL. Только 2 других DUB имеют UBL за пределами группы USP: OTU1 и VCPIP1. USP4, USP7, USP11, USP15, USP32, USP40 и USP47 имеют несколько доменов UBL. Иногда домены UBL находятся в тандеме, например, в USP7, где присутствуют 5 тандемных С-концевых доменов UBL. USP4, USP6, USP11, USP15, USP19, USP31, USP32 и USP43 содержат домены UBL, вставленные в каталитический домен. Функции UBL-доменов различаются между USP, но обычно они регулируют каталитическую активность USP. Они могут координировать локализацию в протеасоме (USP14); негативно регулируют USP, конкурируя за каталитический сайт USP (USP4), и вызывают конформационные изменения для повышения каталитической активности (USP7). Подобно другим доменам UBL, структура доменов USP UBL демонстрирует β-складку.
| домен DUSP | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Структура решения домена DUSP HUSP15. Структура решения домена DUSP HUSP15. | |||||||||
| Идентификаторы | |||||||||
| Символ | DUSP | ||||||||
| Pfam | PF06337 | ||||||||
| InterPro | IPR006615 | ||||||||
| MEROPS | C19 | ||||||||
| |||||||||
Один или несколько тандемных доменов DUSP приблизительно из 120 остатков обнаружены в шести USP. Функция домена DUSP в настоящее время неизвестна, но он может играть роль во взаимодействии белок-белок, в частности, в распознавании субстрата DUB. Это предсказано из-за гидрофобной щели, присутствующей в DUSP-домене USP15, и что некоторые взаимодействия белков с DUSP-содержащими USP не происходят без этих доменов. Домен DUSP отображает новую треножоподобную складку, содержащую три спирали и антипараллельный бета-лист, состоящий из трех нитей. Эта складка напоминает ножки (спирали) и сиденье (бета-лист) штатива. В большинстве доменов DUSP в USP имеется консервативная последовательность аминокислот, известная как мотив PGPI . Это последовательность из четырех аминокислот; пролин, глицин, пролин и изолейцин, которые упаковываются в пучок из трех спиралей и очень упорядочены.
В полной мере роль DUB в заболеваниях еще предстоит выяснить. Их участие в заболевании предсказывается из-за известной роли в физиологических процессах, которые участвуют в болезненных состояниях; включая рак и неврологические расстройства.
Фермент USP28 сверхэкспрессируется при различных типах рака, таких как толстая кишка или легкие. Кроме того, деубиквитинирует и стабилизирует важные онкогены, такие как c-Myc, Notch1, c-jun или ΔNp63.. В плоскоклеточных опухолях, USP28 регулирует устойчивость к химиотерапии, регулируя репарацию ДНК посредством ΔNp63 оси пути анемии фанкония.
Деубиквитинирующие ферменты UCH-L3 и YUH1 способны гидролизовать мутантный убиквитин UBB + 1 несмотря на то, что глицин в положении 76 мутирован.
Уровни UCH-L1 высоки при различных типах злокачественных новообразований (рак ).