 Синаптическая стабилизация молекулами клеточной адгезии
Синаптическая стабилизация молекулами клеточной адгезии Синаптическая стабилизация имеет решающее значение для нервной системы развивающихся и взрослых и считается результатом поздней фазы долгосрочной потенциации (ДП). Механизм включает усиление и поддержание активных синапсов за счет увеличения экспрессии элементов цитоскелета и внеклеточного матрикса и белков постсинаптического каркаса при одновременном сокращении менее активных. Например, молекулы клеточной адгезии (CAM) играют большую роль в поддержании и стабилизации синапсов. Джеральд Эдельман открыл САМ и изучил их функцию во время развития, что показало, что САМ необходимы для миграции клеток и формирования всей нервной системы. В нервной системе взрослого человека САМ играют важную роль в синаптической пластичности, связанной с обучением и памятью.
Молекулы адгезии синаптических клеток (CAM) играют решающую роль в поиске путей аксонов и установлении синапсов между нейронами во время развития нервной системы и являются неотъемлемыми участниками многих синаптических процессов, включая правильное выравнивание пре- и постсинаптических путей передачи сигнала, рециклинг везикул в отношении эндоцитоза. и экзоцитоз, интеграция постсинаптических рецепторов и прикрепление к цитоскелету для обеспечения стабильности синаптических компонентов
SynCAM (также известные как Cadm или нектиноподобные молекулы) представляют собой особый тип синаптических CAM, обнаруженный у позвоночных, который способствует росту и стабилизации возбуждающих (не тормозящих) синапсов. SynCAM локализуются в основном в головном мозге как в пре-, так и в постсинаптических сайтах, и их структуры состоят из внутриклеточных FERM и PDZ-связывающих доменов, одного трансмембранного домена и трех внеклеточных Ig-доменов. Во время развития нервной системы SynCAMs, такие как SynCAM1, действуют как «контактные датчики» конусов роста аксонов, быстро накапливаясь при образовании аксо-дендритных связей и помогая сформировать стабильный адгезионный комплекс.
synCAM1 вместе с нейролигином являются двумя CAM, которые, как известно, достаточны для инициирования образования пресинаптических окончаний, поскольку добавление synCAM1 к среде совместно культивируемых нейрональных и ненейрональных клеток приводит к образованию пресинаптических окончаний. Гомофильное связывание двух молекул synCAM1 на филоподиях конуса роста аксонов и дендритного шипа позволяет установить начальный контакт между пре- и постсинаптическими клетками.
synCAM принадлежат к суперсемейству белков Ig. Цитозольные PDZ-домены synCAM, встроенные в постсинаптическую мембрану, взаимодействуют с постсинаптическим каркасным белком PSD-95, который помогает закрепить комплекс в нижележащем цитоскелете.
 Временное и пространственное распределение комплексов N-кадгерина в развивающихся и зрелых синапсах
Временное и пространственное распределение комплексов N-кадгерина в развивающихся и зрелых синапсах Кадгерины - это кальций-зависимые гомофильные молекулы клеточной адгезии, которые образуют комплексы с цитозольными партнерами, известными как катенины. Компоненты этого комплекса связываются с рядом различных каркасных белков, фосфотаз, киназ и рецепторов. Классические кадгерины имеют пять внеклеточных повторяющихся структур, которые связывают кальций, единственный трансмембранный домен и внутриклеточный хвост с дистальным цитозольным доменом, который связывает катенин-партнер. Недавние исследования показали, что комплекс кадгерин-катенин участвует в ряде различных процессов центральной нервной системы, таких как синаптическая стабилизация и пластичность.
Многие кадгерины в центральной нервной системе обнаруживают различные пространственные и временные паттерны экспрессии. Напр., N-кадгерин широко экспрессируется в развивающемся синапсе и позже остается около зрелой активной зоны, подразумевая, что этот комплекс может быть хорошо приспособлен для обеспечения связи между структурными изменениями и синаптической стабильностью. Фактически, локальные изменения синаптической активности влияют на экспрессию комплексов кадгерин-катенин. Повышение активности в определенном позвоночнике приводит к димеризации N-кадгерина, который затем расщепляется, что приводит к репрессии транскрипции CBP / CREB. Это подавление имеет множество последствий, связанных с развитием и пластичностью.
В случае формирования и обрезки дендритных шипов была предложена и подтверждена гипотеза конкуренции. Эта гипотеза предполагает, что относительные уровни комплексов кадгерин-катенин, которые распределяются между шипами в локальной области зависимым от активности образом, определяют судьбу отдельных шипов. То есть конкуренция между позвоночником за β-катенин определяет, будет ли позвоночник зрелым (увеличенное количество комплексов) или сокращенным (уменьшенное количество комплексов). Это критический механизм во время уточнения кортикальных цепей, происходящих на протяжении всего развития.
Нектины представляют собой отдельное семейство молекул клеточной адгезии. Эти САМ участвуют в начальном контакте пресинаптических и постсинаптических нейрональных процессов во время образования синапсов. В синапсе имеется только четыре хорошо охарактеризованных нектина, это нектин-1, 2, 3 и 4. Все мембраносвязанные нектины имеют внеклеточную область с тремя петлями, подобными иммуноглобулинам. Самая дальняя от мембраны петля называется петлей V-типа, а две более внутренние петли - петлями типа C2. Несколько нектинов на одной клеточной мембране будут связываться вместе в петле V-типа, образуя кластер белков нектина, процесс, называемый цис-кластеризацией. Когда две клетки, обладающие отдельными цис-кластерами, входят в контакт, они образуют сильный комплекс, называемый транс-взаимодействием, который обеспечивает адгезию и, в некоторых случаях, передачу сигналов между двумя клетками.
Наиболее достоверные сведения о роли нектина в синаптической стабилизации получены из синапсов, образованных между окончаниями мшистых волокон и дендритами пирамидных клеток в области СА3 гиппокампа. Нектины, участвующие в образовании и стабилизации этого синапса, - это нектин-1 и нектин-3, которые выступают из плазматической мембраны постсинаптической клетки и пресинаптической клетки, соответственно, образуя гетерофильные внеклеточные контакты. Внутриклеточный домен всех нектинов напрямую связывается с белком, называемым L- афадином. L-афадин - это актин- связывающий белок, который связывается с F-актином актинового цитоскелета. Таким образом, нектины образуют гребневые связи в архитектуре актина клетки, позволяя синапсу развиваться в контролируемой и стабильной среде.
По мере созревания синапсов в области CA3 нектины и кадгерины, которые тесно аффилированы друг с другом в синаптической стабилизации, смещаются к периферии активной зоны и образуют соединение puncta adherens (PAJ). PAJ функционирует так же, как адгезивные соединения в эпителиальных тканях. Смещение этих САМ и образование этого соединения дает возникающим синаптическим мембранам пространство для взаимодействия и созревания, разделяя при этом окружающую мембрану и обеспечивая фиксацию цитоскелета.
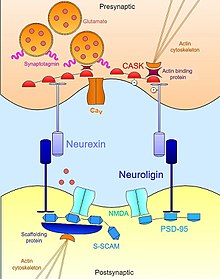 Взаимодействия нейрексин-нейролигин способствуют стабилизации синапсов. На пресинаптической стороне нейрексин связывается с синаптотагмином, кальциевыми каналами. На постсинаптической стороне домен PDZ нейролигина взаимодействует с каркасными белками, которые помогают кластерным рецепторным каналам.
Взаимодействия нейрексин-нейролигин способствуют стабилизации синапсов. На пресинаптической стороне нейрексин связывается с синаптотагмином, кальциевыми каналами. На постсинаптической стороне домен PDZ нейролигина взаимодействует с каркасными белками, которые помогают кластерным рецепторным каналам. Нейрексина - нейролигины взаимодействий помогают установить транс-синаптический функциональную асимметрию, необходимой для стабилизации и поддержания надлежащей синаптической передачи. Пресинаптический нейрексин и его партнер по постсинаптическому связыванию, нейролигин, образуют комплекс на ранних этапах нервного развития и оба, как известно, являются мощными индукторами синаптогенеза. Ненейронных клеток, которые искусственно экспрессируют нейрексин, достаточно для мобилизации постсинаптических специализаций в совместно культивируемых нейронах; Клетки, экспрессирующие нейролигин, также способны индуцировать маркеры пресинаптической дифференцировки в соседних нейронах. Однако, хотя оба они играют важную роль в синаптогенезе, эти молекулы клеточной адгезии не являются необходимыми для образования нейронных связей во время развития. Мутантные мыши с тройным нокаутом нейрексинов или нейролигинов демонстрируют нормальное количество синапсов, но экспрессируют эмбриональный летальный фенотип из-за нарушения нормальной синаптической передачи. Следовательно, они не необходимы для образования синапсов как таковых, но необходимы для созревания и интеграции синапсов в функциональные цепи, необходимые для выживания.
Помимо внеклеточного контакта друг с другом нейрексины и нейролигины также связываются внутриклеточно с обширной сетью адаптерных белков и каркасных структур, которые вместе с актиновым цитоскелетом помогают локализовать необходимые компоненты синаптической передачи. Например, первый обнаруженный нейролигин ( NLGN1 ) был идентифицирован по его домену PDZ, который связывается с PSD95, хорошо известным каркасным белком в глутаматергических синапсах, который функционально связывает рецепторы NMDA с надлежащей постсинаптической локалью. Точно так же другая изоформа нейролигина ( NLGN2 ) взаимодействует с гефирином, каркасным белком, специфичным для ГАМК-ергических синапсов, и отвечает за активацию синаптического адаптивного белка коллибистина. В случае нейрексинов их внутриклеточные связывающие взаимодействия столь же важны для рекрутирования основных механизмов синаптической передачи в активной зоне. Подобно нейролигинам, нейрексины обладают PDZ-доменом, который ассоциирован с CASK ( кальций-кальмодулин-зависимая протеинкиназа ). Помимо фосфорилирования себя и нейрексина, CASK способствует взаимодействию между нейрексинами и актинсвязывающими белками, обеспечивая тем самым прямую связь, с помощью которой нейрексин может модулировать динамику цитоскелета, что важно для синаптической стабильности и пластичности. Нейрексин также может связывать синаптотагмин, белок, встроенный в мембрану синаптических везикул, и может также способствовать ассоциации с потенциалозависимым кальциевым каналом, который опосредует поток ионов, необходимый для экзоцитоза нейротрансмиттеров при синаптической стимуляции. Таким образом, нейрексин и нейролигин координируют морфологические и функциональные аспекты синапса, что, в свою очередь, позволяет зарождающимся незрелым контактам стабилизироваться в полноценные функциональные платформы для нейротрансмиссии.
 Передача сигналов эфрина A3 / EphA4 инициирует каскад событий, которые приводят к регуляции актинового цитоскелета.
Передача сигналов эфрина A3 / EphA4 инициирует каскад событий, которые приводят к регуляции актинового цитоскелета. Нетрадиционные молекулы адгезии, такие как эфрины, также помогают стабилизировать синаптические контакты. Рецепторы Eph и их мембраносвязанные лиганды, эфрины, участвуют во множестве клеточных процессов во время развития и созревания, включая управление аксонами, миграцию нейронов, синаптогенез и обрезку аксонов. В гиппокампе, дендритные позвоночника морфологии может регулироваться астроциты с помощью двунаправленного эфрин / EPHA сигнализации. Астроциты и их отростки экспрессируют эфрин A3, тогда как рецептор EphA4 обогащен нейронами гиппокампа. Это взаимодействие, опосредованное передачей сигналов эфрина A3 / EphA4, вызывает рекрутирование и активацию циклин-зависимой киназы 5 (Cdk5), которая затем фосфорилирует фактор обмена гуанина (GEF), эфексин1. Затем фосфорилированный эфексин1 может активировать малую ГТФазу, RhoA, что приводит к последующей активации ее эффектора, Rho-киназы (ROCK), что приводит к перестройке актиновых филаментов. Посредством этого механизма астроцитарные процессы способны стабилизировать отдельные дендритные выступы, а также их созревание в шипы посредством передачи сигналов эфрина / EphA. Прямая передача сигналов, включающая активацию EphA4, приводит к стабилизации синаптических белков в нервно-мышечном соединении. Как и при EphA4 / ephrinA3-опосредованном взаимодействии нейронов с глией, этот процесс регулирует динамику актинового цитоскелета путем активации ROCK через эфексин.
Передача сигналов Ephrin B / EphB также участвует в стабилизации синапсов посредством различных механизмов. Эти молекулы содержат цитоплазматические хвосты, которые взаимодействуют с белками каркаса через свои PDZ- домены для стабилизации вновь образованных синапсов ЦНС. Например, эфрин B3 взаимодействует с адаптерным белком, взаимодействующим с глутаматным рецептором, белком 1 (GRIP-1), чтобы регулировать развитие возбуждающих синапсов дендритных стержней. Этот процесс, который был идентифицирован в культурах нейронов гиппокампа, показал, что обратная передача сигналов Eph / ephrin B3 рекрутирует GRIP1 на мембрану постсинаптического вала. Попав в ствол мембраны, GRIP1 помогает закрепить рецепторы глутамата ниже пресинаптического терминала. Этот процесс также включает фосфорилирование остатка серина рядом с карбоксильным концом эфрина-B (проксимальнее PDZ-связывающего мотива), что приводит к стабилизации рецепторов AMPA в синапсах.
Другой механизм, обнаруженный в нейронах гиппокампа, показал, что передача сигналов EphB может способствовать созреванию шипов путем модуляции активности Rho GTPase, как это наблюдается с EphAs. Однако, в отличие от EphAs, рецептор EphB2, как было показано, взаимодействует с постсинаптическими рецепторами N-метил-D-аспартата (NMDAR) для привлечения GEF Tiam1 в комплекс при связывании ephrinB. Фосфорилирование Tiam1 происходит в ответ на активность NMDAR, что обеспечивает приток кальция, который активирует Tiam1. Этот механизм также приводит к модуляции актинового цитоскелета. В результате этой стабилизации было обнаружено, что как прямая передача сигналов EphB2, так и обратная передача сигналов эфрина-B3 индуцируют LTP через NMDAR.